

以化學反應中的化學電動勢為例,首先需要明確一件事。 我們先回到電動勢和勢能的概念,回顧一下電勢能和電勢。
【基本概念簡析】
勢能由兩個因素產生:位置和力。 根據百度百科,勢能是一個相對量。 如果選擇不同的勢能零點,勢能的值一般是不同的。 但其核心仍然是力的作用及其作用的距離,如重力勢能、彈性勢能、電勢能等。
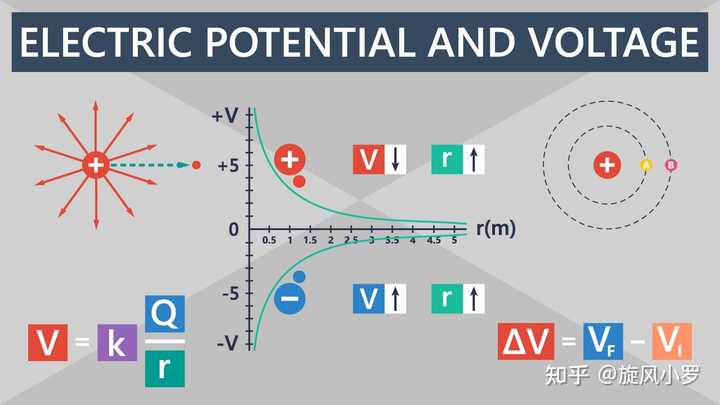
其中,電勢能是電荷由于其在電場中受到的力及其位置而具有的能量。 一般我們假設無窮遠處的電勢能為0,那么電荷從無窮遠移動到目標位置所做的功就是其電勢能的大小。 從物理角度來看,電勢是電荷所在位置的電勢能除以其所攜帶的電荷。 它是一個標量,沒有方向,與電荷量無關,與電場本身的性質有關。
應重點引入電動勢。 這里以化學電動勢為例。 百度百科解釋,電動勢代表非靜電力將單位正電荷通過電源內部從負極移動到正極所做的功與電荷量的比值。 但實際上,電動勢的概念主要強調正負極的位置,而不是任意兩個位置,因此可以與電池的正負極緊密結合在一起。
通過概念分析,大致可以得出結論:電動勢不是勢能的一種,不是電勢能。 它的本質是電位差,是正負極之間的電位差。
【電化學中為什么要引入電動勢? 】
這是因為在電池化學反應的熱力學中,我們需要一個有方向的物理量來與自由能統一。 對于電池反應的電位,負號表示電子過多,正號表示電子缺乏電勢能大小的判斷,這是一個靜電概念。 由于自由能有方向,而電勢沒有方向,因此引入電動勢與自由能統一。 對于電池示意圖(下圖),我們規定右側電極發生還原反應,左側電極發生氧化反應。 電動勢定義為右側電勢與左側電勢的比較。 這樣一來,電動勢無疑就給出了一個方向。
一般我們認為當反應自發時,電動勢Erxn為正,此時滿足:
在標準狀態下,滿足:
這樣,在電化學中,可以通過電動勢來判斷反應自發進行的方向。 正號表示反應自發進行,負號表示反應不能自發進行。
所以可以繼續明確:電動勢不是勢能的一種,也不是電勢能。 它本質上是一個電位差,而且是正負極之間的電位差,可以給電池一個方向! ! ! (這句話應該是解決問題的關鍵)
【電動勢與勢能距離因子有什么關系? 】
至此電勢能大小的判斷,我認為我們可以細化應該問的第三個問題。 化學反應的電動勢與距離的電勢能之間有什么關系? ? 但事實是這樣嗎? 不。 如果電池固定,電動勢就是固定值,電勢能中與距離有關的概念可能就是:電極電勢! 正極電位或負極電位!
這時候我覺得問題應該改為:電極電位與距離的關系。 正負極的電位是確定的,電位差的大小也隨之變化。 這個問題可以參考下面的回答:電極電位和距離有什么關系? 絕對電極電位和相對電極電位?