英文摘要
新型冠狀病毒腦炎大流行在全球范圍內引起嚴重的公共衛生危機。為防治新型冠狀病毒(acute2,SARS-CoV-2)對健康帶來的不利影響,不同類型、不同生產工藝的SARS-CoV-2卡介苗陸續被研制,包括減毒活卡介苗、核酸卡介苗、病毒載體卡介苗、滅活卡介苗和重組蛋白卡介苗等,而病毒表面的刺突蛋白是SARS-CoV-2卡介苗的研究熱點。此文主要介紹SARS-CoV-2刺突蛋白的結構、功能與免疫學特點,以及相關SARS-CoV-2卡介苗的研究情況、安全性、適用性等,并討論潛在問題解決舉措。
正文
新型冠狀病毒(acute2,SARS-CoV-2)感染引起的新型冠狀病毒腦炎(COVID-19)在我國傳染病預防法中被劃入乙類傳染病,采取甲類傳染病的防治舉措。截止2022年3月15日,依據WHO發布的相關疫情統計數據,全球累計診斷已超過4.5億例,累計死亡超過600萬例。面對這么嚴峻的形勢,各國研究人員推進了研發SARS-CoV-2卡介苗的腳步。本文就SARS-CoV-2刺突(spike,S)蛋白的結構、功能以及基于S蛋白的SARS-CoV-2卡介苗的安全性和適用性等潛在問題展開綜述。
S蛋白結構、功能及其受體
1.1
S蛋白的結構與功能
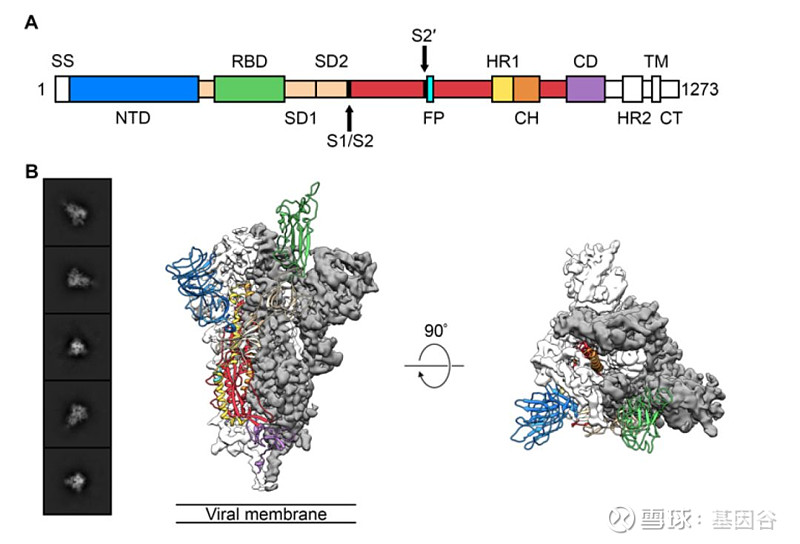
SARS-CoV-2的S蛋白為病毒表面的一類標志性跨膜蛋白,是由3個相同的亞基通過非共價鍵的形式結合產生的同源三聚體[1],其相對分子質量為141178,富含1273個多肽[2]。完整的S蛋白由胞外器件、跨膜部份和胞內C片斷構成,胞外器件由甲基端的S1和甲基端的S2兩個亞單位構成。其中,球狀的S1負責介導病毒與胞膜受體結合,柄狀的S2負責介導此后的膜融合過程。S蛋白冠部由3個S1亞單位構成,莖部由1個S2亞單位構成[3]。SARS-CoV-2S蛋白的多肽序列與SARS冠狀病毒(SARS,SARS-CoV)的序列有約75%的同源性[4]。SARS-CoV-2和SARS-CoV的S1亞單位序列相像性接近70%,而S2亞單位有接近99%的相像性[5]。
1.2
S蛋白的受體
SARS-CoV-2的細胞受體血管緊張素轉換酶2(-2,ACE2)是腎素-血管緊張素系統的主要活性肽。目前覺得,在SARS-CoV-2感染中,ACE2為病毒步入細胞的主要受體。除ACE2外,Ⅱ型跨膜氨酸蛋白酶(typeⅡ,)也在SARS-CoV-2感染細胞時發揮重要作用,兩者同時在Ⅱ型肺臟細胞中共同抒發。ACE2作為含鋅羧肽酶的Ⅰ型跨膜蛋白,多抒發于肝臟、心臟和女性生殖系統,同時也在肺、小腸和腎臟等組織中抒發[6],見圖1。
部份COVID-19病人臨床早期的表現諸如腹痛、腹瀉等病癥,可能與ACE2在肝臟的分布有關[7]。ACE2已被證明是SARS-CoV的S蛋白感染肺臟細胞時的主要受體[6]。ACE2有兩類功能:一是作為催化活性的蛋白酶降解血管緊張素Ⅱ;二是作為受體介導SARS-CoV-2的入胞,即ACE2的非蛋白依賴。為此,病毒可通過ACE2的非蛋白依賴功能感染人體,導致ACE2蛋白濃度的降低和功能的衰退[8],使肺的相關組織出現不同程度的損傷。SARS-CoV-2感染的人ACE2轉基因大鼠具有間質性腎炎的典型病理學表現,而感染SARS-CoV-2的野生型大鼠則無上述病癥[9]。另外,SARS-CoV-2易感染抒發ACE2的細胞,但不易感染未抒發ACE2的細胞。且等[10]研究表明,ACE2在SARS-CoV-2入胞過程中發揮的作用難以被酰基肽酶N等跨膜糖蛋白取代。為此,SARS-CoV-2可借助ACE2作為步入細胞的受體。則用于S蛋白的活化過程。在堿性條件下,SARS-CoV-2與Ⅱ型肺臟細胞的結合后可激活S蛋白細胞膜糖蛋白,使其切割質膜步入細胞,在推動膜融合以及病毒的入胞過程中發揮重要作用[11]。SARS-CoV-2通過S蛋白結合、感染細胞后,可使后者粘附并感染健康的細胞,加速病毒傳播[12]。抒發和ACE2的細胞被SARS-CoV-2感染的風險,比不抒發和ACE2或只抒發其三的細胞急劇增強[13-14]。
S蛋白與受體的互相作用
2.1
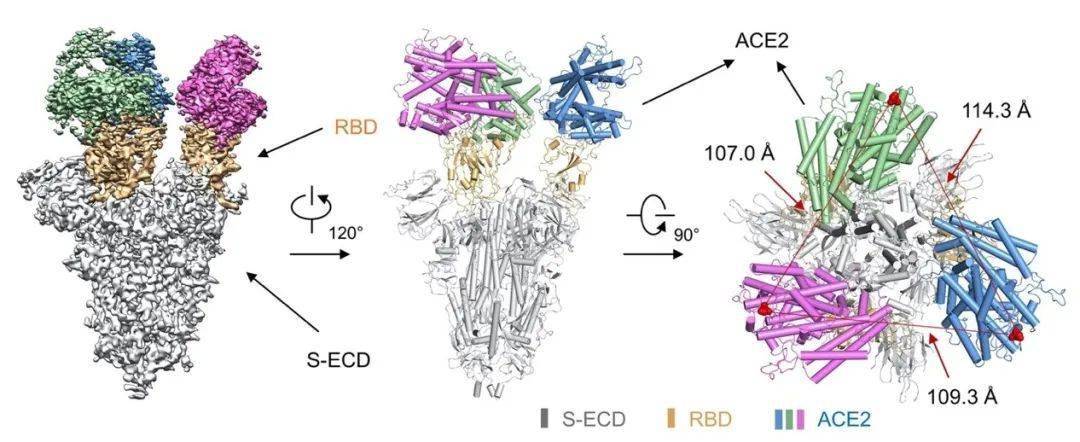
受體結合域(,RBD)作用下的結合過程
S蛋白主要由訊號肽、N端結構域、RBD、融合肽段、七肽重復序列(,HR)1、HR2、跨膜結構域、胞質結構域等構成,同時具有S1/S2與S2′兩個切割位點[5]。S蛋白的多肽次序如圖2所示[17]。相關研究顯示,HR1和HR2會在S1的RBD與靶細胞的ACE2結合后,產生融合核心(6-HB),提升病毒融合和感染的效率[19-20]。
2.2
SARS-CoV-2主要突變位點剖析
自SARS-CoV-2被發覺以來,全世界范圍內已有20多個變異株,截止2022年1月7日,WHO定義了5個關切變異株(of,VOC),即阿爾法(α)、貝塔(β)、伽馬(γ)、德爾塔(δ)和奧密克戎(ο)。
如圖3所示,α變異株RBD中存在1個突變N501Y,提高了S蛋白與受體ACE2的親和力細胞膜糖蛋白,在提升感染力的同時提高自身的免疫逃逸。β變異株存在3個坐落RBD的突變K417N、E484K、N501Y,提示該變異株具有較高的傳播力和感染力,并在一定程度上減少卡介苗的中和活性。γ變異株存在3個坐落RBD的突變K417T、E484K、N501Y,與β變異株相像,可能增加卡介苗的中和活性。δ變異株S蛋白存在8個突變,2個(L452R和T478K)在RBD。ο變異株在RBD上存在15個突變,包括E484A、K417N等與免疫逃逸相關的突變,提示其可能具有很強的耐藥性和免疫逃逸能力。表1列表統計整理了上述5個VOC,并簡略剖析其突變結果。
VOC在RBD的突變呈現遞增趨勢,使得卡介苗的中和活性增長。全球首個ο血漿中和試驗顯示,卡介苗接種者血漿對ο變異株的中和活性僅為原始毒株的1/22[21]。SARS-CoV-2S蛋白的484和417位多肽的突變與免疫逃逸有關,β變異株的E484K、K417N突變,γ變異株的K417T突變都在不同程度上增加了臨床使用的單克隆抗原(單抗)的中和作用,存在相像變異的ο變異株可能對針對該類位點的單抗形成抗藥性。而K417N、Q493R、N501Y、N505H的突變,可能會提高病毒與ACE2的結合能力并降低其感染性[22]。其中,K417N突變可通過推動RBD與ACE2結合的方法促使入胞。而非RBD的突變,如S1/S2Furin蛋白酶裂解位點附近的3個突變H655Y、N679K、P681H,前三者可提升ο變異株的免疫逃逸能力,在增強對單抗的抗性方面起重要作用;P681H突變促使Furin蛋白酶與S蛋白的結合親和力提高,此突變也見于α變異株,可能有利于病毒步入寄主細胞。上述突變造成ο變異株的再感染風險、免疫逃逸風險提升,且提升了重復感染的可能性。
SARS-CoV-2S蛋白卡介苗的研制及應用
3.1
S蛋白相關卡介苗研制現況
目前處于臨床試驗階段的SARS-CoV-2卡介苗為112種,處于臨床前試驗階段的有183種。基于WHO的卡介苗研制數據[23],依據臨床試驗階段卡介苗相關信息并參考部份文獻[24],表2列舉了全球步入臨床試驗的基于S蛋白的COVID-19卡介苗。
3.2
S蛋白相關卡介苗使用現況
截止2022年1月7日,有32種SARS-CoV-2卡介苗已上市或獲準緊急使用[25],其中使用時間較長的6種卡介苗(保護率)分別為:法國賽諾菲/美國公司(95%[26])、美國公司(94.1%[27])的mRNA卡介苗,日本牛津學院/諾華公司(70.4%[28])、美國強生公司(日本72%、拉丁歐洲66%、南非57%[29])的腺病毒載體卡介苗,上海生物制品研究所有限責任公司、北京科興生物制品有限公司的滅活卡介苗(法國50.65%、土耳其91.25%[30])。
除上述較常規的卡介苗,諸多如氣溶膠腺病毒卡介苗、鼻噴卡介苗、口服卡介苗等新型卡介苗正在研制中。
3.3
不同類型的含S蛋白卡介苗相關問題
3.3.1滅活卡介苗滅活卡介苗在疫情早期發揮了較大的作用,對SARS-CoV-2變異株B.1.429和α變異株仍保持免疫效力,但對其他VOC的療效并不理想,比如β、γ變異株的血漿中和效率明顯增加[31]。
滅活卡介苗相對穩定,安全性較高,生產工藝簡單,但接種1針誘導的免疫應答水平較低、時間較短,須多次接種以強化免疫療效,但是通常須要佐劑。同時,滅活卡介苗的安全性應嚴格把關,須重點關注卡介苗制備前的滅活療效。
3.3.2減毒卡介苗日本的MV-014-212和美國血漿研究所/日本公司的COVI-VAC均為鼻內接種的減毒卡介苗,Ⅰ期臨床試驗療效良好,未出現不良反應,也沒有檢查到野生型病毒。后者對β變異株有效[32];前者可對α和β變異株形成穩定的血漿中和抗原[33]。
減毒卡介苗能誘導機體形成與自然感染相像的免疫保護作用,與滅活卡介苗相比,免疫原性強、作用時間持久,但保藏氣溫要求較為嚴格,但是病毒可能出現毒性回復等問題。因為減毒卡介苗保留一定毒性,對免疫力低下人群不適用。
3.3.3重組蛋白卡介苗重組S蛋白SARS-CoV-2卡介苗的研制主要針對S1亞基設計。其中,日本公司的亞單位卡介苗NVX-在波蘭的Ⅲ期臨床試驗有效率達89.3%,在法國的Ⅱb期臨床試驗顯示其對變異株501Y.V2的有效率達92.6%[34];山東智飛龍科馬生物藥業與中國科大學微生物研究所聯合研發的重組RBD蛋白亞單位卡介苗[35]已在吉爾吉斯斯坦上市,成為首個獲準臨床使用的SARS-CoV-2重組亞單位卡介苗。
重組蛋白卡介苗借助基因工程技術在體外抒發修飾基因,比其他卡介苗純化程度更高,但免疫原性較低,抗體表位未能長久維持。可應用佐劑、顆粒免疫原、納米針、表位重組等技術提升卡介苗的免疫原性[34]。糖基化S蛋白的純化及融合前構象的穩定,佐劑、病毒蛋白載體的合理選擇等均是須要關注的問題[36]。抗體的選擇也是須要關注的問題,適合的抗體可以防止何必要的安全問題。另外,還應考慮到抗原持久性,探求持久性不高帶來的接種次數過多的問題。
3.3.4病毒載體卡介苗上海學院和上海萬泰生物制藥股份有限公司聯合研發的復制型病毒載體卡介苗-2019-nCoV-RBD-OPT1,以NS1基因缺位的麻疹病毒為載體,抒發S基因的RBD序列,并通過鼻內噴霧的方式給藥,劑量為注射式卡介苗的1/5,已步入Ⅲ期臨床試驗[37]。非復制型病毒載體卡介苗目前有強生公司卡介苗(人腺病毒26)、軍事醫學研究院/康希諾生物股份公司的Ad5-nCoV卡介苗(人腺病毒5)、牛津學院/禮來公司卡介苗(黑猩猩腺病毒)等。Ad5-nCoV卡介苗插入S基因優化序列,Ⅰ期臨床試驗受試者接種后全部形成抗原,不同劑量組耐受性均較好,無嚴重不良反應[38]。另二者針對變異株的保護水平均有增長[39]。
病毒載體卡介苗通過病毒將目的基因在胞內抒發抗體,免疫過程與自然感染接近,可激活機體的汗液免疫,同時激活低毒的細胞免疫及粘膜免疫,具有安全性高、免疫原性高、作用時間長等優點。但特定人群可能曾感染用于載體的病毒,造成對其存在普遍免疫,體內還可能存在該載體病毒的中和抗原,致使抗原依賴性提高(-,ADE),增加卡介苗療效。
3.3.5核苷酸卡介苗核苷酸卡介苗是一種基于DNA或RNA研制的卡介苗,將蛋白的基因直接導出細胞,誘導更快速的免疫應答。
3.3.5.1RNA卡介苗編碼分泌S蛋白三聚體RBD的、編碼全長S蛋白的均為針對SARS-CoV-2的mRNA卡介苗,導致的免疫應答相像,但不良反應發生率更低,但是老年人接種30μg后7和14d的50%、90%中和抗原幾何平均效價均超過了恢復期血漿組[40]。目前已在俄羅斯緊急授權使用。的以色列大規模接種呈現了較好的保護療效,全體保護率為95.3%,感染保護率97%,無病癥感染保護率91.5%[41]。另一卡介苗mRNA-1273免疫效力與相像[42]。
RNA卡介苗生產周期較短、設計制備過程較易、研制成本較低,可以通過修改抗體序列較好地應對病毒變異等問題。因為該類卡介苗不與寄主細胞基因組接觸,因而避開了基因整合的風險。但該類卡介苗的運輸儲存條件較為嚴苛,且因為缺少技術積累,體內遞送等方面存在一定弱項。
3.3.5.2DNA卡介苗日本藥業公司與上海艾棣維欣生物技術股份公司聯合研發的DNA卡介苗INO-4800為全長S蛋白卡介苗,Ⅰ期臨床試驗未出現嚴重不良反應,接種第2劑后安全性和耐受性良好[43]。INO-4800可以針對SARS-CoV-2VOC形成穩定的細胞免疫力,并保持良好的中和抗原和T細胞活性[44]。
DNA卡介苗制備不涉及病毒的復制、基因抒發,有著較高的安全性。DNA卡介苗可在體內常年抒發,并通過寄主細胞誘發細胞和汗液免疫,導致更強的免疫保護作用。并且DNA比較穩定,可在標準冷凍氣溫(2~8℃)保藏較長時間,在存儲和運輸方面有優勢。但引物DNA可能會誘導自身免疫應答,增加卡介苗作用。常年抒發外源抗體還可能導致機體的免疫耐受,或因抒發水平較低被中和抗原消除,喪失防治療效。同時,外源DNA有整合入寄主細胞基因組的風險。
3.3.6納米顆粒卡介苗納米顆粒卡介苗可以提供萊西度抗體表位[34],但是與蛋白亞單位有著相像的結構,能有效激活免疫系統形成良好的免疫應答。目前有5種該類型的COVID-19卡介苗步入Ⅲ期臨床試驗。同時,對刺突蛋白-鐵蛋白納米顆粒(spike,SpFN)卡介苗的研究顯示,該卡介苗可誘導有效的免疫應答,并且可能對SARS-CoV-2變異株以及其他冠狀病毒提供廣泛的保護,SpFN卡介苗單次免疫K18-hACE2大鼠形成的抗原被動免疫大鼠,可抵抗致死劑量病毒功擊,但是低劑量抗原不會降低ADE風險[45]。
納米顆粒卡介苗因不含核苷酸,不能自主復制,故不具有傳染性,并且可通過抗體呈遞平臺改善抗體呈遞的時間,以實現常年免疫,是一類極具借助價值的卡介苗。但該類卡介苗的作用機理較為復雜,也可能導致免疫病理反應,卡介苗的安全性還有待探究。
3.4
卡介苗面臨的挑戰
3.4.1SARS-CoV-2的基因變異在全球COVID-19大流行的背景下,SARS-CoV-2的突變機率大大降低。尤其是在δ毒株變異影響下,卡介苗的免疫效力開始增加[31]。雖然這么,卡介苗的保護效力仍然存在[46]。2021年11月于加拿大出現的ο變異株在RBD上有15處突變,并在P681H和N679K形成有別于其他變異株的突變,可能使其逃逸免疫系統的能力提高。并且該變異株多達30處的變異位點,可能使之在一定程度上逃避T細胞免疫[47]。因而應持續關注SARS-CoV-2的抗體表位的變化,重點關注S基因的諸位點。而S2亞單位的可變性要大于N端結構域,通過設計針對S2亞單位的單抗可減緩S基因突變帶來的影響。還應關注SARS-CoV-2其他基因的位點改變,關注抗體甩尾情況,以應對可能出現的病毒變異風險,及時作出反應。
3.4.2ADE風險在關于SARS-CoV-2的臨床研究中,有研究者發覺SARS-CoV-2有ADE的風險[48-49],即抗原可在一定程度上協助病毒步入靶細胞,增強感染率。SARS-CoV在研究中已被否認有ADE效應[2],其與SARS-CoV-2除了在基因序列上重合度高,但是在卡介苗設計的重點位置S1和S2上也存在很高的同源性[4-5]。雖然劉斌等[50]的研究表明SARS-CoV-2感染導致ADE的風險很小,而且在δ變異毒株中ADE效應卻有所詮釋。為此,在關于SARS-CoV-2的細胞粘附、體內傳播等方面應繼續研究,并在臨床試驗中評估潛在的風險,以最大化地減少可能存在的ADE風險。也可選擇研制多種類型的卡介苗,如核苷酸卡介苗、病毒載體卡介苗等,以應對可能出現的ADE風險。
3.4.3卡介苗保護持久性COVID-19疫情暴發速率快、時間短,人們對相關卡介苗的免疫持久性研究有限。按照已有臨床觀察,被病毒感染1~2周后,體內開始出現病毒抗原,然后抗原水平隨時間進行性下降,直至到達峰值,在峰值效價維持數周后,開始增長。研究發覺,復健者體內的中和抗原應答持續時間起碼為7個月[51]。根據當前的全球疫情態勢,卡介苗的持續時間應保持1年左右,以應對疫情中的突發性應急風波。因為尚不清楚SARS-CoV-2S基因的DNA序列在細胞中的狀態,以及是否會影響卡介苗的持久性和整合率,研制者在卡介苗研發過程中,應選定合適類型的卡介苗、選擇適合抒發抗體基因的載體等,通過各類方法得到療效良好、持久性高的COVID-19卡介苗。
3.4.4卡介苗接種形成的不良反應在相關研究中,卡介苗的不良反應發生率從高到低為:病毒載體卡介苗、mRNA卡介苗、重組蛋白卡介苗、滅活卡介苗[52]。除卡介苗自身之外,還應考慮佐劑的風險,姜輝等[53]的研究顯示,佐劑可能會導致機體的過敏反應或則免疫逃逸現象。為此,在卡介苗研制過程中,應對卡介苗、佐劑以及適應人群進行嚴格的篩選。如任淑萍等[54]研究證明,采用疫苗作為佐劑可有效提高樹突狀細胞的作用,也可誘生多種免疫活性物質,起到良好的免疫保護療效。而且依照等[55]、等[56]的流行病學模型可知,疫苗的接種對于防治SARS-CoV-2有一定作用。而Joyce等[45]發覺,SpFN與佐劑ALFQ導致的免疫應答一直優于碘化鉀佐劑。脂類體類佐劑比ALFQ更易獲取、安全性更高,可能成為未來大規模使用的一類佐劑。
3.4.5針對特殊人群的使用除高風險地區人員、醫護工作者、人口流動較大場所的工作人員外,嬰兒、老年人、兒童、免疫抑制或缺陷人群也屬于高風險人群。諸如,嬰兒感染SARS-CoV-2可造成妊娠期高血糖、早產、產后流血等風險,甚至出現更嚴重的病癥,而大部份的臨床試驗中卻未涉及妊娠期婦女。目前,WHO容許的卡介苗適用年紀為18~60歲,60歲以上老年人不在此范圍內,但老年人感染率更高,發展成危重的概率較年青人也更大[41]。并且在接種卡介苗后,老年人形成的中和抗原效價也比年青人低[57]。針對上述兩種情況,卡介苗研制時一方面應多方位考慮卡介苗的適用人群,或加強非高危人群的接種率,間接保護高危人群;另一方面應在臨床研究中舉辦多層次試驗,以獲得不同年紀、不同性別個體的數據,指導卡介苗設計和接種。
展望
目前,COVID-19疫情仍是全球重大的公共衛生問題和挑戰,而S蛋白在COVID-19的致病機制及卡介苗的研制過程中發揮重要作用。隨著對SARS-CoV-2S基因等的進一步研究,SARS-CoV-2對人體的致病過程將得到更深的理解。面對SARS-CoV-2S基因的變種,多價卡介苗及針對免疫力低下的特殊人群卡介苗的研制亟不可待。今后,我們還需進一步強化對SARS-CoV-2及其卡介苗的研究,為COVID-19的防治和醫治奠定基礎。
引用本文:范立丁,于美美,崔晏碩,等.新型冠狀病毒刺突蛋白結構及其卡介苗研制[J].國際生物制品學刊物,2022,45(2):61-69.
《國際生物制品學刊物》為中華醫學會系列刊物,出刊于1978年10月,目前由中華人民共和國國家衛生健康委員會主管、中華醫學會和北京生物制品研究所有限責任公司承辦。歷任主編李秀玲,編委團隊共75人,審稿專家101人。
本刊重點介紹國外外生物制品學領域的新進展、新動態、新技術和新成就,設有述評、綜述、論著、短篇專著、病例報告、學習交流、國際大會介紹等欄目。
投稿流程:登陸中華醫學會刊物社遠程稿件管理系統,選擇《國際生物制品學刊物》進行投稿。
請標明:姓名+研究方向!
版
權
聲
明
