


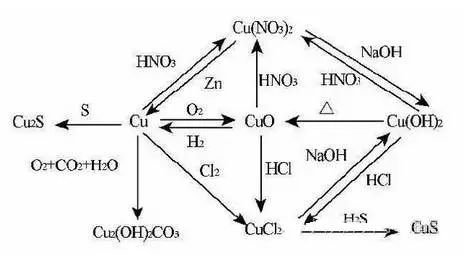
高中常見化學方程式的分解反應:
1、水在直流電作用下分解:2H2O 2H2↑+O2↑
2.加熱堿式碳酸銅:Cu2(OH)2CO3加熱2CuO+H2O+CO2↑
3.加熱氯酸鉀(含少量二氧化錳):====2KCl+3O2↑
4.加熱高錳酸鉀:加熱+MnO2+O2↑
5、碳酸不穩定,分解為:H2CO3===H2O+CO2↑
6、高溫煅燒石灰石:CaCO3高溫CaO+CO2↑
高中化學方程式中常用的氧化還原反應:
1、氫還原氧化銅:H2+CuO加熱Cu+H2O
2、木炭還原氧化銅:C+2CuO高溫2Cu+CO2↑
3、焦炭還原氧化鐵:3C+高溫4Fe+3CO2↑
4、焦炭還原四氧化三鐵:2C+Fe3O4高溫3Fe+2CO2↑
5.一氧化碳還原氧化銅:CO+CuO加熱Cu+CO2
6、一氧化碳還原氧化鐵:3CO+Fe2O3高溫2Fe+3CO2
7.一氧化碳還原四氧化三鐵:4CO+Fe3O4高溫3Fe+4CO2
高中常見化學方程式
元素、氧化物、酸、堿、鹽
1.金屬元素+酸--------鹽+氫(置換反應)
1.鋅與稀硫酸Zn+H2SO4=ZnSO4+H2↑
2.鐵與稀硫酸Fe+H2SO4=FeSO4+H2↑
3.鎂與稀硫酸Mg+H2SO4=MgSO4+H2↑
4.鋁與稀硫酸2Al+=Al2(SO4)3+3H2↑
2.金屬元素+酸--------鹽+氫(置換反應)
1.鋅與稀硫酸Zn+H2SO4=ZnSO4+H2↑
2.鐵與稀硫酸Fe+H2SO4=FeSO4+H2↑
3.鎂與稀硫酸Mg+H2SO4=MgSO4+H2↑
4.鋁與稀硫酸2Al+=Al2(SO4)3+3H2↑
3. 酸 + 鹽 -------- 另一種酸 + 另一種鹽
1、大理石與稀鹽酸的反應:CaCO3+2HCl===CaCl2+H2O+CO2↑
2、碳酸鈉與稀鹽酸反應:+2HCl===2NaCl+H2O+CO2↑
3、碳酸鎂與稀鹽酸反應:MgCO3+2HCl===MgCl2+H2O+CO2↑
4. 鹽 + 鹽 – 兩種新鹽
1、氯化鈉溶液與硝酸銀溶液:NaCl+AgNO3====AgCl↓+NaNO3
2、硫酸鈉與氯化鋇:+BaCl2====BaSO4↓+2NaCl
高考化學知識點《化學精選》
1. 單一物質在室溫下會形成有色氣體的元素有F和Cl。
2.與水反應最劇烈的非金屬元素是F。
3. 最高價氧化物水合物中酸性最強的元素是Cl
4. 單一物質最易液化為氣體的元素是Cl
5.氫化物沸點最高的非金屬元素是O
6.其單一物質是最輕的金屬元素鋰
7.單質在室溫下為液態的非金屬元素是Br。
8.熔點最低的金屬是汞
9. 氣態氫化物最易溶于水的元素是N
10. 導電性最好的金屬是銀
11. 相對原子質量最小的原子是 H
12. 人體內最豐富的元素是O
13. 日常生活中最廣泛使用的金屬是鐵
14. 組成化合物種類最多的元素是C
15.自然界中最堅硬的物質是鉆石
16.金屬活性系列中最活潑的金屬是K。
17.地殼中最豐富的金屬元素是鋁
18.地殼中最豐富的非金屬元素是O
19. 空氣中最豐富的物質是氮
20.最簡單的有機物質是甲烷
21. 在相同條件下,密度最小的氣體是氫氣
22.相對分子質量最小的氧化物是水
高考化學50個小知識點
1、掌握一圖(原子結構圖)、五式(分子式、結構式、簡化結構式、電子式、最簡式)、六式(化學方程式、電離方程式、水解方程式、離子方程式、電極方程式、熱化學方程式)的正確寫法。
2.最簡分子式相同的有機物: ①CH:C2H2和C6H6 ②CH2:烯烴和環烷烴 ③CH2O:甲醛、乙酸、甲酸甲酯 ④:飽和單醛(或飽和單酮)及其碳原子數的兩倍和飽和單羧酸或酯;例如:乙醛(C2H4O)與丁酸及其異構體( )
3、一般原子的原子核由質子和中子組成,但氕原子(1H)中沒有中子。
4. 元素周期表中的每一周期不一定以金屬元素開始。例如,第一周期以氫開始。
5、IIIB族元素種類最多,碳形成的化合物種類最多,IVA族元素構成的晶體往往是原子晶體,如金剛石、晶體硅、二氧化硅、碳化硅等。
6. 質量數相同的原子不一定屬于同一元素,例如18O和18F,40K和40Ca
7.IVA~VIIA族元素中,僅VIIA族元素沒有同素異形體,其元素不能直接與氧化合。
8、活潑金屬與活潑非金屬一般形成離子化合物,但AlCl3是共價化合物(它有很低的熔點和沸點,容易升華,是二聚體分子,所有原子都已達到最外層有8個電子的穩定結構)。
9.一般來說,元素性質越活潑,其單質的性質也越活潑,但N和P則相反,因為N2形成了三鍵。
10.非金屬元素一般形成共價化合物,但NH4Cl等銨鹽是離子化合物。
11.離子化合物在通常狀態下不以單分子形式存在,但在氣態下卻以單分子形式存在,例如NaCl。
12、含有非極性鍵的化合物不一定是共價化合物。例如Na2O2、FeS2、CaC2等都是離子化合物。
13.元素分子不一定是非極性分子,例如O3就是極性分子。
14、一般氫化物中,氫的價數為+1,但金屬氫化物中,氫的價數為-1,如NaH、CaH2等。
15、非金屬元素一般不導電,但是石墨可以導電,硅是半導體。
16、非金屬氧化物一般都是酸性氧化物,但CO、NO等不是酸性氧化物,而是不成鹽的氧化物。
17、酸性氧化物不一定和水發生反應:如SiO2。
18、金屬氧化物一般都是堿性氧化物,但有些高價金屬氧化物是酸性氧化物,如Mn2O7、CrO3等,它們是酸性氧化物,2KOH+Mn2O7==+H2O。
19、非金屬元素最高正價態與其負價態絕對值之和等于8,但氟沒有正價態,氧在OF2中價態為+2。
20. 含有陽離子的晶體不一定含有陰離子。例如,金屬晶體含有金屬陽離子,但不含有陰離子。
21、離子晶體不一定只含有離子鍵,例如NaOH、Na2O2、NH4Cl等也含有共價鍵。
22、稀有氣體原子的電子層結構一定是穩定結構,其他原子的電子層結構一定不是穩定結構。
23.離子的電子層結構必須是穩定的結構。
24.陽離子的半徑必定小于相應原子的半徑,陰離子的半徑必定大于相應原子的半徑。
25.一個原子所形成的高價陽離子的半徑一定小于該原子低價陽離子的半徑。
26.同類原子之間的共價鍵必定是非極性鍵,不同原子之間的共價鍵必定是極性鍵。
27. 分子中不得有離子鍵。如果標題中有“分子”一詞,則該物質必須是分子晶體。
28 單個物質分子一定不能含有極性鍵。
29 共價化合物一定不能含有離子鍵。
30 含有離子鍵的化合物必定是離子化合物,形成的晶體必定是離子晶體。
31、含有分子的晶體必定是分子晶體,其它晶體必定不含分子。
32、單元素晶體絕對不是離子晶體。
33、化合物形成的晶體肯定不是金屬晶體。
34.分子晶體中一定包含分子間力,其他晶體中一定不存在分子間力(石墨除外)。
35.對于雙原子分子,如果鍵是極性的,則分子必定是極性的(極性分子);如果鍵是非極性的,則分子必定是非極性的(非極性分子)。
36、氫鍵也是分子間相互作用的一種,它只影響分子晶體的熔點、沸點,對分子穩定性沒有影響。
37.粒子不一定指原子,也可以是分子、陰離子、陽離子、基團(如羥基、硝基等)。例如10e-的粒子:Ne;O2-、F-、Na+、Mg2+、Al3+;OH-H3O+、CH4、NH3、H2O、HF。
38、難以失去電子的原子并不一定具有很強的獲取電子的能力,例如碳和稀有氣體。
39.原子最外電子層有2個電子的元素不一定是ⅡA族元素,如He、副族元素等。
40.原子最外電子層有1個電子的元素不一定是IA族元素,如Cr、IB族元素等。
41.IA族元素不一定是堿金屬元素,也包括氫。
42.長周期元素與短周期元素組成的族不一定是主族,還有0族。
43.分子不一定有化學鍵。例如,稀有氣體是單原子分子,沒有化學鍵。
44.共價化合物可能含有非極性鍵,例如過氧化氫、乙炔等。
45、含有非極性鍵的化合物不一定是共價化合物。例如過氧化鈉、二硫化亞鐵、醋酸鈉、CaC2等都是離子化合物。
46. 對于多原子分子來說,鍵是極性的,但分子不一定是極性的。例如,二氧化碳和甲烷是非極性分子。
47、含有陽離子的晶體不一定是離子晶體,例如金屬晶體。
48. 離子化合物不一定是鹽。例如,Mg3N2和金屬碳化物(CaC2)是離子化合物,但不是鹽。
49. 鹽不一定是離子化合物。例如,氯化鋁和溴化鋁是共價化合物。
50. 固體不一定是晶體。例如,玻璃是無定形物質,塑料和橡膠也是。
高考化學知識點
元素化合物

1、堿金屬元素的原子半徑越大,熔點越高,元素的活性越大。
2、硫磺和白磷均易溶于二硫化碳、四氯化碳等有機溶劑,而有機酸較難溶于水。
3、在飽和硫酸銅溶液中加入適量濃硫酸,生成藍色固體,濃硫酸吸收水分后,生成硫酸銅沉淀。
4、能和冷水反應放出氣體的元素只有活潑的金屬元素或者活潑的非金屬元素。
5. 將空氣液化,然后逐漸升高溫度,先生成氧氣,其余為氮氣。
6、生鐵冶煉成碳鋼主要要解決的問題是除去生鐵中除Fe以外的各種元素,以及對生鐵進行凈化。
7、自然界中含鉀物質雖然易溶于水,但土壤中K%不高,因此需要施用鉀肥才能滿足植物生長的需要。
8、生石灰用于生產漂白粉、配制波爾多液及改良酸性土壤。漂白粉的生產是生石灰與Cl2反應,波爾多液是生石灰與硫酸銅混合而成。
9.二氧化硅是酸性氧化物,不溶于酸溶液。
10、將鐵屑溶解于過量的鹽酸中,再加入氯水、溴水、碘水或硝酸鋅,均有Fe3+生成。
11、常溫下,濃硝酸可以存放在鋁罐中,也就是說鋁不和濃硝酸發生反應。
12、向Ca(ClO)2、NaOH等飽和溶液中通入CO2,有白色沉淀出現。繼續通入CO2直至過量,白色沉淀仍不消失。
13、大氣中大量的二氧化硫來自于煤、石油的燃燒和金屬礦石的冶煉。
14. 清澈的溶液是NH4Cl、AgNO3、NaOH三種物質的混合物,如果加入足量的硝酸,就會產生白色沉淀。NH4Cl、AgNO3、NaOH混合后發生反應,生成[Ag(NH3)2]+。加入足量的硝酸后,生成AgCl和。
15、為了充分利用原料,必須對硫酸工業的尾氣進行凈化回收。
16. 與足量的NaOH溶液反應,總共將轉移3mol的電子。
17.硫化鈉既不與苛性鈉溶液反應,也不與氫硫酸反應。
18、在含有高濃度Fe3+的溶液中,SCN-、I-、AlO-、S2-、CO32-、HCO3-等不能大量共存。Fe3+可以與SCN-配位,與I-、S2-發生氧化還原反應,與CO32-、HCO3-、AlO2-發生復水解反應。
19、活性炭、二氧化硫、氯水等都能使品紅褪色,但反應性質不同。活性炭吸附品紅,是物理變化,SO2生成不穩定化合物,是可逆的,氯水發生氧化還原反應,是不可逆的。
20、乙酸乙酯、三溴酚、醋酸鈉、液溴、玻璃、重晶石、重鈣等能與燒堿發生反應。
21、將一定量的Cl2通入FeBr2溶液中,可生成FeBr3、FeCl2、Br2。
22、由于Fe3+與S2-能發生氧化還原反應,所以Fe2S3不存在。
23、在次氯酸鈉溶液中通入少量二氧化硫,可得到亞硫酸鈉和次氯酸。
24. 5.6 克鐵與足夠的酸反應,轉移 0.2NA 的電子。
25、含最高價元素的化合物不一定具有強氧化性高中物理的化學方程式,如稀HClO4、H2SO4等。
26、元素的還原能力越弱,其陽離子的氧化能力越強。
27.將CO32-加入到Cu2+溶液中可以制備CuCO3。
28、若元素X能從鹽溶液中置換出元素Y,則元素X和Y的物質性質可以是:(1)金屬與金屬;(2)非金屬與非金屬;(3)金屬與非金屬;(4)非金屬與金屬;。
29、H2S、HI、FeCl2、濃H2SO4、苯酚等溶液在空氣中長期放置,會因氧化還原反應而變質。
30、濃硝酸、濃硫酸在室溫下能和銅、鐵等發生反應。
高考化學筆試題分析與總結

1、濃硫酸稀釋:
在燒杯中加入一定量的蒸餾水,將濃硫酸沿燒杯內壁慢慢倒入,并用玻璃棒不斷攪拌。
2、用pH試紙測量溶液的酸堿度:
用一根干燥潔凈的玻璃棒浸入待測液體中,放在pH試紙的中央,與標準比色卡對比,讀出溶液的pH值。
3、用試紙測試氣體:
(以NH3為例)用玻璃棒將濕潤的紅色石蕊試紙貼在集氣瓶或試管口上,看試紙是否變藍色。
4、檢查裝置氣密性(以大試管單孔塞為例):
①微熱法:將導管插入水槽內,手握大試管,若有氣泡從導管口冒出,松手時有一柱水從導管口回流,則說明該器械氣密性良好。
②液差法:將橡皮塞塞緊,用止水夾夾住導氣管橡皮管部分,從長頸漏斗向試管內倒入水,使長頸漏斗內液面高于試管內液面,經過一段時間,液面差無變化高中物理的化學方程式,說明氣密性良好。
5.火焰顏色反應:
(以K元素為例)將干凈的鉑絲浸入測試溶液中,在酒精燈火焰上燃燒,透過藍色鈷玻璃觀察火焰是否呈紫色。(注:用鹽酸溶液清洗鉑絲)。
6.洗滌沉淀物:
將蒸餾水沿玻璃棒倒入濾膜內,直至沒過沉淀物,靜置讓蒸餾水濾出,重復2~3次。
7、如何判斷沉淀劑是否充足:
將沉淀物加入到上清液中(或取少量上清液,放入小試管中),若無沉淀產生,即表示沉淀已完全。例如在原鹽凈化實驗中,判斷BaCl2是否過量的方法是:繼續向上清液中加入BaCl2溶液,若溶液沒有變渾濁,即表示BaCl2過量。
8、如何判斷沉淀物是否洗干凈:
取少量最后一次洗滌液,逐滴加入相應的試劑……
9.提取分離操作:
關閉分液漏斗的活塞,將混合液體倒入分液漏斗中,充分振搖留學之路,靜置分層,在漏斗下方放置一小燒杯,打開分液漏斗的活塞,讓下層液體從下口沿燒杯壁流下;將上層液體從上口倒出。
10.氣體測量操作注意事項:
當溫度恢復到室溫時,調節量筒(或氣體量管),使左右液面水平。
11、酸堿中和滴定終點的判定:
例如用強堿滴定強酸時,用酚酞作指示劑,當最后一滴酸滴入錐形瓶時,溶液由紅色變為無色,半分鐘內不再變色。(延伸:氧化還原滴定,如用KMnO4滴定草酸:溶液由無色變為淡紫色,半分鐘內不再褪色。)

12.長導管在有機實驗中的作用:
冷凝回流提高了反應物的利用率。
13、氫氧化鐵膠體的制備:
將飽和FeCl3溶液逐滴加入沸騰的蒸餾水中,當溶液變成紅棕色時,立即停止加熱。
14. 清洗玻璃器皿的標準是:
它既不聚集成水滴,也不流淌成溪。
15. 引發鋁熱反應的操作:
加入少量KClO3,插入鎂棒并點燃。
16. 檢測鹵代烴中鹵素原子的操作:
取試樣與NaOH溶液一起加熱,然后加HNO3酸化,再加AgNO3溶液,根據沉淀的顏色判斷。
幾秒內記住金屬活性序列表的公式
原配方:
鉀、鈣、鈉、鎂、鋁;
鋅、鐵、錫、鉛、氫;
銅、汞、銀、鉑、金。
因為太難記,所以又推導出一個新公式:
娶那個美麗的女人;
身體,身材,精致,修長,輕盈;
總共一百斤。
現在我已經背熟了……
精制
顏色
消除
興趣
//