

氫原子的能級:
1. 氫原子能級圖
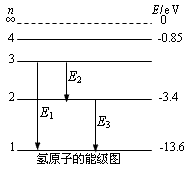
2. 光子的發(fā)射和吸收
①原子在基態(tài)時最穩(wěn)定,當(dāng)它們處于較高能級時,會自發(fā)地躍遷到較低能級,經(jīng)過一次或幾次躍遷到達基態(tài)高中物理等效半徑,躍遷過程中以光子的形式釋放能量。
② 原子在其初始能級Em與最終能級En(m>n)之間躍遷時放出的光子頻率為ν,其大小可由下列公式確定:hυ=Em-En。
③如果原子吸收某一頻率的光子,原子就會獲得能量,由低能級躍遷到高能級。
④ 當(dāng)原子處于第n能級時,可能觀察到的不同類型的波長N為:
。
⑤原子的能量包括電子的動能與電勢能(電勢能由電子和原子共同承擔(dān)),即原子的能量En=EKn+EPn。軌道越低,電子的動能越大,但電勢能越小,原子的能量也變小。
電子的動能:
,r越小,EK越大。
氫原子的能級及有關(guān)物理量:
在氫原子中,電子圍繞原子核運動。如果把電子的運動看作軌道半徑為r的圓周運動,原子核與電子之間的庫侖力提供了電子做勻速圓周運動所需的向心力。那么根據(jù)庫侖定律和牛頓第二定律,我們有
,但
①電子移動速率
② 電子的動能
③電子運動周期
④電子在半徑為r的軌道上的電勢能

⑤等效電流
從以上公式可以看出,電子繞原子核運行的軌道半徑越大高中物理等效半徑,電子的運行速度越小,動能越小,電子運動的周期越長,每條軌道上的電視能量越大。
確定原子躍遷過程中譜線數(shù)量的方法:
1.直接轉(zhuǎn)型與間接轉(zhuǎn)型
原子從一種能態(tài)躍遷到另一種能態(tài)時,有時可能是直接躍遷,有時是間接躍遷,兩種情況下輻射(或吸收)光子的頻率可能不同。
2. 一組原子和一個原子
氧原子的原子核外只有一個電子,這個電子在某一時刻只能處在一個可能的軌道上,在一定時間內(nèi),它從一個軌道跳到另一個軌道時,只有一種可能的情況。然而,如果容器中含有大量的氫原子,這些原子的原子核外電子跳變時,就會出現(xiàn)各種各樣的情況。
3.當(dāng)一組氫原子處于量子數(shù)為n的激發(fā)態(tài)時,可能輻射的譜線數(shù)為
如果氫原子處于高能級,對應(yīng)量子數(shù)n,那么可以躍遷到量子數(shù)為(n-1)、(n-2)、(n-3)……1的能級,形成共(n-1)條譜線。躍遷到量子數(shù)(n-1)的氫原子,也可以躍遷到量子數(shù)為(n-2)、(n-3)……1的能級,形成共(n-2)條譜線。同樣,也可以形成(n-3)、(n-4)……1條譜線。綜合以上分析結(jié)果,從對應(yīng)量子數(shù)n的能級到低能級(n-1)、(n-2)……1,可以形成的譜線總數(shù)為(n-1)+(n-2)+(n-3)+……+1=n(n-1)/2。數(shù)學(xué)上表示為
4.當(dāng)氫原子處于量子數(shù)為n的激發(fā)態(tài)時,可能輻射的譜線數(shù)為
對于量子數(shù)為n的氫原子來說,它有可能直接躍遷,只發(fā)射一個光子,也有可能先躍遷到中間能級再躍遷回基態(tài),發(fā)射兩個光子,也可能分步躍遷,即先躍遷到n-1能級,再躍遷到n-2能級,……,最后回到基態(tài),共發(fā)射n-1個光子。也就是說,氫原子在發(fā)生能級躍遷時,至少會發(fā)射一個光子,至多發(fā)射n-1個光子。
利用能量守恒和氫原子能級特征解決躍遷電離問題的方法:
原子躍遷和電離過程中,總能量仍然守恒。原子受激發(fā)時貝語網(wǎng)校,原子的初始能級與最終能級之差等于吸收的能量,即入射光子的總能量或入射粒子的全部或部分能量;原子電離時,電離能等于原子電離前能級的絕對值,原子吸收的能量等于原子電離能與電離后電離電子的動能之和;原子輻射時,輻射出的光子的能量等于原子的初始能級與最終能級之差。氫原子的能級F與
,第n能級與量子數(shù)n2成反比,導(dǎo)致相鄰能級間的能量差不相等。量子數(shù)n越大,相鄰能級間的能量差越小,且第n能級與第n-1能級間的差大于第n能級與無窮遠處能級間的差,即
此外,能級差的大小
因此,也可以利用光子能量來判斷能級差的大小。
過渡和電離:

刺激方式:

相關(guān)高中物理知識點:玻爾原子理論
玻爾的原子理論:

古典理論的困難
原子的穩(wěn)定性
電子加速時應(yīng)該輻射電磁波,逐漸降低能量和軌道半徑,最終落入原子核,原子是不穩(wěn)定的,事實并非如此。
原子光譜的離散性
電子繞原子核旋轉(zhuǎn)的輻射頻率應(yīng)該等于電子繞原子核旋轉(zhuǎn)的頻率,由于軌道的縮小,輻射出的電磁波頻率應(yīng)該不斷變化,形成連續(xù)的光譜,這與原子光譜——亮線光譜(固定頻率)不一致。
玻爾理論
實驗基礎(chǔ)
氫原子光譜的離散特征
理論基礎(chǔ)
普朗克的黑體輻射量子理論和愛因斯坦的光子理論
玻爾理論
量化假設(shè)
①電子軌道是量子化的,電子軌道半徑不是任意的,只有滿足一定條件的半徑的軌道才有可能,電子在這些軌道上繞原子核旋轉(zhuǎn)是穩(wěn)定的,不會產(chǎn)生電磁輻射。
②原子的能量是量子化的,這些量子化的能量值叫做能級。原子中這些具有一定能量的穩(wěn)定狀態(tài)叫做定態(tài)。能量最低的狀態(tài)叫做基態(tài),其他狀態(tài)叫做激發(fā)態(tài)。
頻率條件
當(dāng)電子從能量較高的定常軌道(Em)躍遷到能量較低的定常軌道(En)時,會發(fā)射出一個能量為hv的光子,這個光子的能量由兩個能級之間的能量差決定,即hv=Em-En。
光譜解釋
原子光譜的離散性
正常情況下,原子處于基態(tài),是穩(wěn)定的,激發(fā)態(tài)的原子是不穩(wěn)定的。原子從高能態(tài)躍遷到低能態(tài)時發(fā)射出的光子的能量等于前后兩個能級之差。由于原子的能級是離散的,發(fā)射出的光子的能量也是離散的。因此,原子的發(fā)射光譜只有一些離散的亮線。
特征譜線
由于不同原子的結(jié)構(gòu)和能級不同,其輻射(或吸收)的光子頻率也不同,這就是為什么不同元素的原子具有不同的特征譜線。
氫譜線系列
玻爾理論不僅成功地解釋了氫光譜的巴耳末系,還解釋了當(dāng)時已發(fā)現(xiàn)的另一種氫光譜線系——帕申系(在近紅外區(qū))。它是電子從n=4、5、6等能級躍遷到n=3能級時輻射出來的。此外,玻爾理論還預(yù)言了當(dāng)時還未發(fā)現(xiàn)的其它氫原子譜線系。這些線系后來陸續(xù)被發(fā)現(xiàn),也與玻爾理論的預(yù)言相一致。
玻爾原子理論的成功和局限性:
玻爾的原子論首次把量子觀引入原子領(lǐng)域,提出了定態(tài)和躍遷的概念,并成功解釋了氫原子光譜的規(guī)律。但玻爾引入的量子化觀并不完善。在量子力學(xué)中,原子核外的電子并沒有確定的軌道,玻爾的電子軌道只是電子出現(xiàn)概率比較大的地方。當(dāng)用圖像來表示電子的概率分布時,小黑點的疏密就代表了概率的大小。其結(jié)果就像是電子在原子核周圍形成的云,被稱為“電子云”。
本文來自:逍遙右腦記憶//.html