同學們大家好! 首先,恭喜你升入高中,成為一名高中生!
“化學”是您將要學習的課程。 此前,你在初中的《科學》課程中已經學到了很多化學知識。 學好這些化學知識,培養相應的能力,對于學好高中化學是非常必要的。 相對而言,初中的化學知識比較分散,記憶較多,基礎不牢,缺乏系統性。 高中《化學》課程是一門子學科課程,知識邏輯性、系統性強,教學量大,進度快,知識點多,學科內綜合性強。 特別是化學知識的掌握和對教學內容的理解難度有了很大的提高。 更重要的是硫的相對原子質量,對學習能力、理解問題的視角、對學科思維和方法的理解要求都比較高。 因此,如何做好初中和高中化學的銜接,讓你進入高中后能夠盡快適應高中的學習,并在原有的知識水平上穩步邁向新的臺階,你需要有效總結初中所學的化學基礎知識。 ,有序組織、存儲,合理構建知識網絡。
第一講:化學改變世界
1.奇妙的化學反應
我們身邊的衣食住行各個方面都涉及到各種各樣的物質。 這些物質的成分、結構和性質是什么? 物質變化的規律是什么? 化學是研究這些問題的科學。 化學可以幫助我們正確認識物質,指導人類合理利用資源,促進科學技術的發展。 是化學讓世界更加豐富多彩、更加迷人!
知識結構:
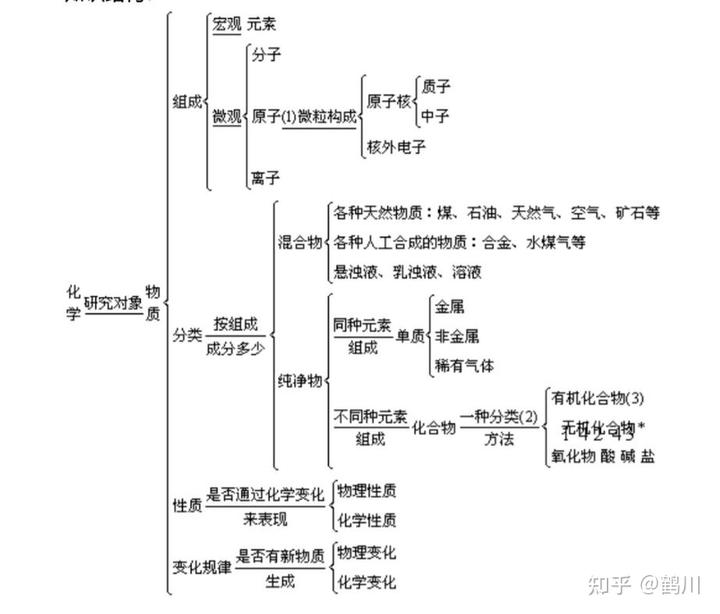
2. 物質的組成
(1) 要素
元素是具有相同核電荷(即質子數)的同一類型原子的總稱。
1、物質是由元素組成的,各種化學元素組成了各種物質世界。 每種元素可以單獨形成一種或幾種不同的元素(同素異形體),也可以按一定的化合價與其他元素形成化合物。 而且,相同種類和數量的元素可以形成不同化學式的化合物。 具有相同化學式的化合物(異構體)。 由于它們可以按照一定的規則以不同的方式組合,110多種元素組成了各種各樣的物質。
2.記住一些常見元素的符號和名稱,以及它們在自然界中(地殼中和空氣中)的分布。 1、元素符號、常用元素符號:
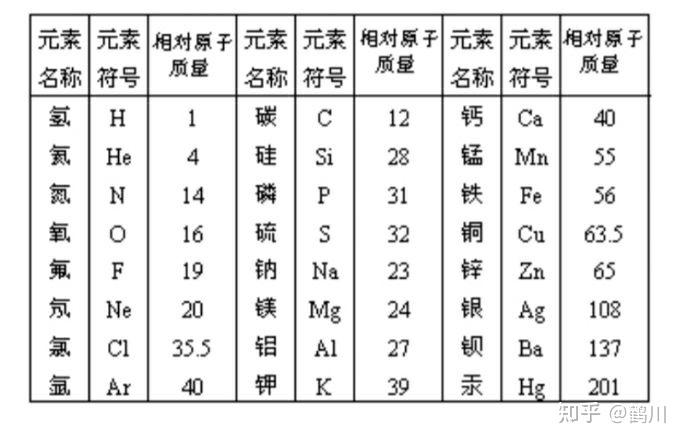
(1)書寫規則:國際通用的符號用元素拉丁字符的第一個大寫字母表示。
例如:氧,表示為O 氫,表示為H。當第一個字母與其他元素重復時,可以寫元素名的第二個字母以示區別,并用小寫表示,如Na、Ca、Cu , ETC。 。
(2)元素符號的含義:①代表元素。 ② 該元素的原子。
以N(氮)為例說明:可以表示為氮元素,也可以表示為氮元素的氮原子。
思考:2H是什么意思? (因為元素只講類型不講數量,所以在H前面加一個任意系數2,即2H和H的含義不同。2H只表示為2個氫原子,注意不能是據說可以表示為兩個氫元素)
3、元素是代表物質宏觀組成的概念。 它是同一類型原子的總稱。 因此,元素沒有數量的概念。 我們只討論類型,不討論數字。
4、質子數是劃分元素種類的標準。 質子的數量決定了元素的類型。 具有相同質子數的原子和簡單離子應包含在同一元素中。
5. 元素是物質的基本組成部分。 元素只能存在于特定的物質(單質或化合物)中。 沒有具體的物質,抽象元素就不存在。 物質中元素的存在狀態有兩種:一種是自由態,元素以單質形式存在的狀態稱為自由態;另一種是自由態。 另一種是化合物狀態,元素以化合物形式存在的狀態稱為化合狀態。
6. 元素分布
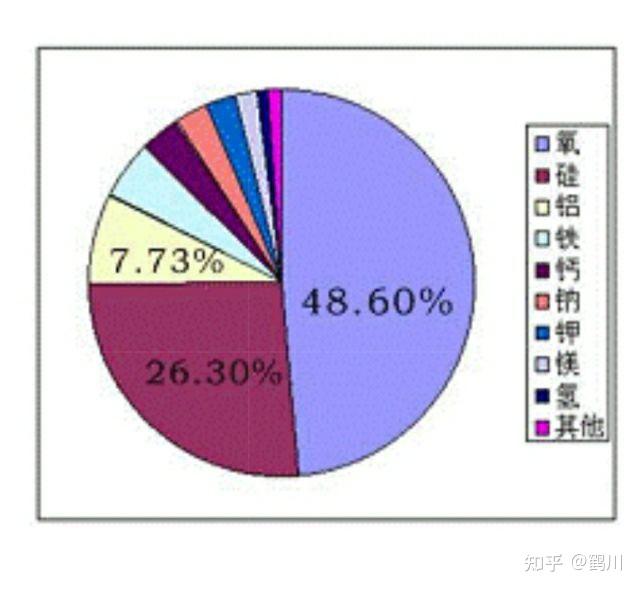
(1)地殼中的元素:氧>硅>鋁>鐵
(2)海水中的元素:水除由氫、氧元素組成外,還含有氯、鈉等。
(3)有機化合物主要由碳、氫、氧三種元素組成。
(4)人體內元素:含量最多的元素是碳、氫、氧、氮。
7.“化合價”是元素形成化合物時顯示的性質。 化合物有正價和負價。 例如,在H2O中,氧元素的化合價為-2,氫元素的化合價為+1。 這里不能說氧原子的價數為-2,氫原子的價數為+1。 在化合物中,正價和負價的代數和等于0; 在元素分子中,元素的化合價為零。 某些原子團還顯示出某些化合價,例如 OH- 表示 -1 價,SO42- 表示 -2 價。 有些元素在不同的反應條件下還表現出不同的化合價,稱為變化合價。 例如,鐵的化合價為+2或+3。 記住一些常見元素的化合價。
圖片
小貼士:記住一價鉀、鈉、氯化物、氫、銀、二價鈣、鋇、鎂、鋅、三鋁、四硅、五價磷、二、四、六硫,不要忘記元素含量始終是零。
7.元素周期表簡介
目前已知元素有110多種。 為了研究元素的性質和用途,尋找元素之間的內在聯系和規律,科學家們將元素按照核電荷數從小到大的順序從左到大進行排序。 右邊將它們按從上到下的順序排列,即可得到元素周期表。
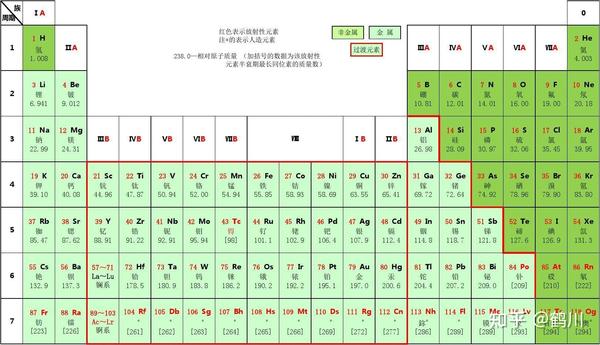
元素周期表的內容非常豐富。 表中的每個元素都有一個包含七個水平行(即七個句點)的網格。 同一周期的元素具有相同數量的電子層。 縱向共18行,分為7個主族、7個副族、1個零族、1個VIII族(包括第7、8、9行)。 同一主族或副族的元素最外層電子數相同,零族為稀有氣體元素。 同一族的元素具有相似的化學性質。
(2) 構成物質的三種粒子─分子、原子、離子
物質是由粒子組成的,不同的物質又是由不同的粒子組成的。 分子、原子和離子是構成物質的三種粒子。 有些物質是由分子組成的,有些物質是由原子組成的,有些物質是由離子組成的。
1、分子分子是一種保持物質化學性質的粒子(這里強調的是保持物質的化學性質),
它可以獨立存在。 分子是由原子組成的。 在化學反應過程中,分子可以分裂成原子,原子又可以重新組合形成新的分子。 分子有一定的大小和質量。 同一種分子具有相同的性質,不同種類的分子具有不同的性質。分子不斷變化
運動(蒸發、溶解、擴散等現象都是分子運動的例子),分子之間有一定的距離(物質的三態變化是分子間距離變化的結果)。 分子是構成物質的粒子。 一些非金屬元素(如O2、H2、Cl2、S、P等)、氣態化合物(如HCl、H2S、SO2等)、酸和有機化合物都是由分子組成的。
2、原子是化學變化中最小的粒子(原子的化學變化中,原子核保持不變,只有原子核外的電子發生變化。在原子物理學中,原子一旦發生核裂變或核聚變,就稱為原子核)反應。這種變化不是化學反應)。 原子不能在化學反應中分離,也不能變成其他原子。 原子是構成分子和離子的基本粒子。 原子可以先形成分子,然后再形成物質; 原子也可以直接形成物質(如金剛石、石墨和稀有氣體等)。 直接由原子組成的物質中的原子保留了原有物質的化學性質。 原子在類型和數量上都是特定的微觀粒子。 當我們描述物質的宏觀成分時,我們應該說它是由什么元素組成的; 當我們描述物質的微觀組成時,我們應該說出它是由什么粒子(包括原子、分子和離子)組成的,并指定粒子的數量。 例如:水是由氫和氧組成的; 水分子由兩個氫原子和一個氧原子組成。
原子也有大小和質量,并且也在不斷運動。 。 在科學中,一般不直接使用原子的實際質量,而是用相對原子質量來表示。 按照國際規定,以C-12原子質量的1/12(約1.66×10 kg)為標準。 其他原子的質量與它的比值就是該原子的相對原子質量。 相對原子質量的單位為1,一般不表示。
3. 離子 離子是帶電的原子或原子團。 (所謂原子團是指由多個原子組成的原子團,參與化學反應時,通常很難分開,就像一個原子一樣。) 帶正電荷的稱為陽離子,帶正電荷的稱為陽離子。負電荷稱為陰離子。 離子與原子的本質區別在于:①原子(及原子團)不帶電,而離子帶電(電性質不同); ②同一元素的原子和離子具有不同的外圍電子層結構和不同的半徑(不同的結構)。 ③性質不同(如鈉原子、鈉晶體,銀白色金屬光澤,化學性質活潑,與水劇烈反應放出氫氣,有強還原性;鈉離子無色,性質穩定,不與水或酸反應,僅具有弱氧化性)。 同一元素的原子和離子具有幾乎相同的質量,并且可以相互轉化。 由離子組成的物質包括大多數鹽類、強堿和低價金屬氧化物。 由離子組成的物質只能形成化合物。 例如,活性金屬(鉀、鈉、鈣、鎂等)與活性非金屬(如氯等)化合時,生成的物質由離子組成。 氯化鈉由鈉離子和氯離子組成。
4.探索原子的組成
① 原子結構
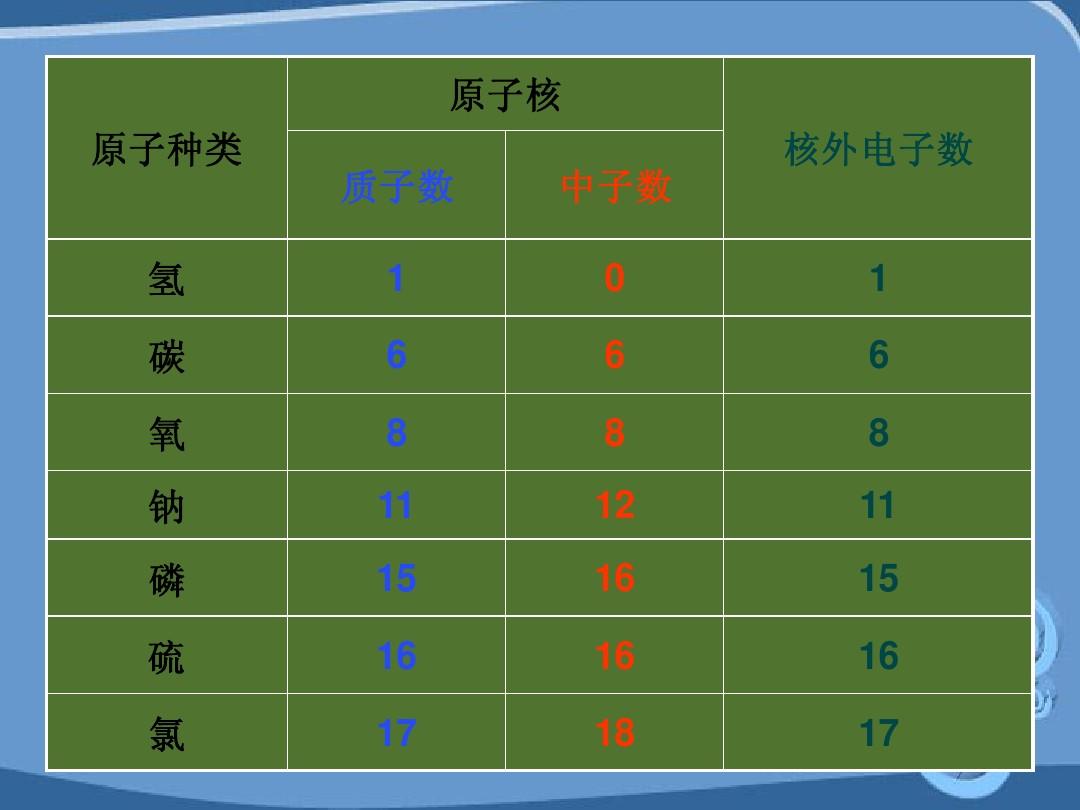
原子由原子中心帶正電的原子核和原子核外帶負電的電子組成。 電子繞原子核高速運動。 1個電子攜帶1個單位的負電荷。 原子核由質子和中子組成。 一個質子攜帶一單位正電荷,中子不帶電荷。 因此,原子核帶有正電荷(原子核所帶的電荷稱為核電荷)。 原子核所帶的正電荷 電荷等于原子核外電子所帶負電荷的總數。 由于電荷相等,電性相反,所以整個原子呈電中性。
對于原子來說,核電荷數=質子數=核外電子數
原子中電子的質量占整個原子質量的比例很小,約為質子質量的1/1836,可以忽略不計。 因此,原子的質量主要集中在原子核上。
科學家還研究了質子和中子的組成,發現質子和中子是由更小的粒子夸克組成的。
②同位素:原子核中質子數相同、中子數不同的同一類型的原子統稱為同位素。
(2)材料成分的表示方法
1.化學式相對分子質量
(一)化學式的含義
用元素符號表示物質組成的公式稱為化學式。 在宏觀層面上,化學式代表一種物質及其由哪些元素組成。 微觀上,它代表物質的分子和分子中所含原子的數量。 例如,H2O,宏觀上代表水,表明水是由氫和氧元素組成的。 微觀上,它代表一個水分子,由兩個氫原子和一個氧原子組成。
化學式中元素符號周圍數字的含義:前面的系數表示分子的數量,下標數字表示分子中原子的數量。 例如,3H2O代表三個水分子。 一個水分子由兩個氫原子和一個氧原子組成。
另一個例子是硫酸根離子,

(2)化學式的書寫方法
各種物質的化學式是通過實驗方法確定的。
⑴如何寫簡單物質的化學式
金屬元素、非金屬單質固體和稀有氣體均用元素符號表示,如鐵(Fe)、硫(S)、氦(He)等。 氧氣、氫氣和氮氣等常見氣體元素是雙原子分子硫的相對原子質量,化學式為 O2、H2 和 N2。
⑵ 化合物的化學式怎么寫
① 書寫氧化物的化學式時,氧元素在右邊,其他元素在左邊。 如SO2。
② 如何寫出金屬和非金屬元素組成的化合物的化學式,左邊是金屬,右邊是非金屬。 如氯化鈉。
③根據“化合物中各元素正負價態的代數和為零”的原理,根據該物質的化學式可以計算出該元素的化合價。 用化合價寫出已知物質的化學式。
實施例1 已知鉀元素的價態為+1,氧元素的價態為-2。 計算高錳酸鉀中錳元素的化合價。
高錳酸鉀的化學式是KMnO4。
根據化合價原理:
(+1)×1+錳價數×1+(-2)×4=0
例2 已知硫具有一定的氧化物,其中硫元素的化合價分別為+4和+6。 寫出這種硫氧化物的化學式。
①首先寫出組成該化合物的元素的符號。 一般將正價元素的符號寫在左邊,負價元素的符號寫在右邊。 在元素符號上方標出相應的化合價。
②求兩個元素化合價絕對值的最小公倍數:4。
③求各元素的原子數:最小公倍數/正價(或負價)的絕對值=原子數
④ 將原子序數填在相應元素符號的右下角(原子數為1時不標),即可得到+4價硫氧化物的化學式。
⑤檢查各元素正負價數的代數和是否為零。 如果不為零,則化學式不正確。
(+4)×1+(-2)×2=4-4=0
(3)如何讀化學式
由兩種元素組成的化合物通常從右到左讀為“某種化學物質”。 例如,P2O5 發音為五氧化二磷。
(4) 相對分子質量
①相對分子質量:分子中原子的相對原子質量之和就是該分子的相對分子質量。
3. 物質的分類
為了更好地認識物質,人們常常根據物質的組成、狀態、性質等對物質進行分類。例如,根據物質存在的狀態,將物質分為氣態物質、液態物質和固態物質;根據物質存在的狀態,將物質分為氣態物質、液態物質和固態物質; 根據物質的導電性,將物質分為導體、半導體和絕緣體; 根據物質在水中的溶解度,物質分為可溶性物質、微溶性物質
性物質和難溶性物質。
科學家根據物質的成分對物質進行分類:

(1)物質分類的相關概念
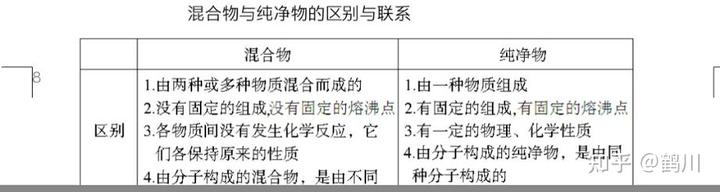
1、混合物:由不同分子組成的物質。 如:空氣、溶液等。
2、純物質:由同種分子組成的物質。 如:氧氣(O2)、氯化鈉(NaCl)等。
混合物與純物質的區別與聯系
注意:
由相同元素組成的物質不一定是純物質(如O2、O3); 組成相同(如最簡單的分子式和分子式相同)的物質不一定是純凈的物質。 必須充分考慮是否存在同素異形體或異構體。
3、元素:由相同元素組成的純凈物質。 例如:金屬元素[鋁(Al)、鐵(Fe)等]、非金屬元素[硫(S)、碳(C)等]。
4、化合物:由不同元素組成的純物質。
(1)氧化物:由兩種元素組成的化合物,其中一種元素是氧。 根據是否能與酸或堿反應生成鹽和水,可分為成鹽氧化物(指正常情況下能通過直接化學反應形成鹽的氧化物。大多數氧化物屬于成鹽氧氧化物質); 非成鹽氧化物(不能與酸、堿反應生成相應價態的鹽和水氧化物,如一氧化碳(CO)、一氧化氮(NO)等)。
①酸性氧化物(又稱酸酐):能與堿反應生成鹽和水的氧化物。 如:二氧化硫(SO2)、二氧化碳(CO2)等。
②堿性氧化物:能與酸反應生成鹽和水的氧化物。 如:氧化鈉(Na2O)、氧化鎂(MgO)、氧化鈣(CaO)等。
③兩性氧化物:既能與酸、堿反應生成鹽和水的氧化物。 如氧化鋁(Al2O3)、氧化鋅(ZnO)等。
注意:
①堿性氧化物一定是金屬氧化物,但并非所有金屬氧化物都是堿性氧化物。 一些高價金屬氧化物如Mn2O7、Cr2O3等也是酸性氧化物。
②酸性氧化物不一定是非金屬氧化物,非金屬氧化物也不一定是酸性氧化物。 有些非金屬氧化物如CO、NO等不易形成鹽,不是酸性氧化物。
③有些非金屬氧化物雖然能與水反應生成酸,也能與堿反應生成鹽,但它們不是NO2等酸性氧化物。
④酸酐不一定都是氧化物。 例如,一些有機酸酐,例如乙酸酐(CH3CO)2O,不一定直接與水反應形成酸,例如SiO2。
(2)酸:電離時產生的陽離子全部為氫離子的化合物。 如一元酸[鹽酸(HCl)、硝酸(HNO3)等]、二元酸[硫酸(H2SO4)、碳酸(H2CO3)等]、多元酸[磷酸(H3PO4)等] .]。 又如含氧酸[硫酸(H2SO4)、硝酸(HNO3)等]、厭氧酸[鹽酸(HCl)、硫酸氫(H2S)等]。
注意:
①常用酸的酸度順序為:HClO4(最強)>HI、HNO3>HBr>HCl>H2SO4>H2SO3>H3PO4>HF>>H2CO3>H2S>HClO>(難溶)。
②其他提酸方式:
難熔酸(高沸點酸):濃硫酸、濃磷酸。
揮發性酸(低沸點酸):HCl、HNO3、HBr、HI、HF。
易分解酸(不穩定酸):HClO、H2CO3、H2SO3、HNO3。
強氧化性酸:濃H2SO4、HNO3、HMnO4、HClO。 (指成酸元素的氧化性)
弱氧化酸:稀HCl、稀H2SO4。
還原酸:H2S、濃HCl、HBr、HI、H2SO3。
(3)堿:電離時產生的陰離子全部是氫氧根離子的化合物。 如一元堿[氫氧化鈉(NaOH)、氫氧化鉀(KOH)等]、二元堿[氫氧化鋇(Ba(OH)2)、氫氧化鈣(Ca(OH)2)等]、多元堿[氫氧化鐵(Fe(OH)3)等]。
注意:
堿按性質可分為強堿(在水溶液中完全電離的堿,能溶于水,屬于可溶性堿)和弱堿(在水溶液中不能完全電離的堿,氨除外)一水合物NH3·H2O,一般難以電離)易溶于水,為不溶性堿。
(4)鹽:由陰離子和陽離子組成的化合物。 如正鹽[碳酸鈉()、硫酸鈉()等]、酸式鹽[碳酸氫鈉()、硫酸氫鈉()等]、堿式鹽[堿式碳酸銅(Cu2(OH)2CO3)、 ETC。 ]。
注意:
①酸鹽的水溶液不一定呈酸性。 只有強酸的酸鹽才呈酸性。 酸鹽的水溶液呈酸性。 弱酸等的酸鹽的水溶液呈堿性。
②復鹽:電離時能電離成兩種以上金屬陽離子和一種酸離子的鹽稱為復鹽。 中學階段要了解的重點有:明礬KAl(SO4)2·12H2O、硫酸亞鐵銨(NH4)2SO4·FeSO4·6H2O等。
③物質顏色:
固體:(請在括號內填寫化學式)
黑色:氧化銅(CuO)、氧化鐵(Fe3O 4 )、二氧化錳(MnO 2 )、碳粉(C);
藍色:CuSO4.5H2O(硫酸銅晶體)、氫氧化銅Cu(OH)2;
綠色:銅綠Cu2(OH) 2CO 3 黃色:硫(S) 紫色:銅(Cu);
紅棕色:氧化鐵(即鐵銹)(Fe2O3); 紅棕色:氫氧化鐵Fe(OH)3
紫黑色:高錳酸鉀(KMnO4)
解決方案:
含有Cu2+的溶液呈藍色如:CuCl2、CuSO4、Cu(NO3)2
含有 Fe3+ 的溶液呈黃色,如: FeCl3 Fe2(SO4)3 Fe(NO3)3
其他常見的堿、鹽的固體大部分呈白色(氯化鈉、硝酸鉀等晶體為無色),溶液大部分為無色。
4.物質的變化和性質
物理變化:一種物質在變化過程中不產生其他物質的變化。
1.物質的變化(僅形式的變化)
化學變化:一種物質在變化過程中產生其他物質的變化。
(本質是物質結構發生了變化)
物理性質:物質在不發生化學變化的情況下所能表現出的性質(物質本身
2.物質的性質所顯示的狀態、顏色、氣味、硬度、密度、熔點、沸點、溶解度等稱為物理性質)。
化學性質:物質在化學變化過程中出現的性質。 可燃性、還原性、氧化性、穩定性、酸堿度、金屬活性等。
注意以下幾點
⑴了解化學變化的特點:化學變化過程中,分子發生變化,產生新的物質。 因此,化學變化是在質變中發生的。 新物質的產生是化學變化的第一個特征; 化學變化是原子的再生。 分布和組合,從原子水平來看,原子的類型、原子的數量、原子的質量在反應前后都沒有變化,因此質量守恒。 這是化學變化的第二個特征; 物質的化學反應常常伴隨著能量的變化,這是化學反應的第三個特征。
⑵ 水合物晶體失去結晶水的變化,或無水物形成水合物晶體的變化,都是化學變化。
⑶ 同素異形體之間的轉變是化學變化。 (因為它們的結構完全改變了)
⑷物質的變化和性質是不同的概念。 例如:“氫氣可以燃燒”和“氫氣燃燒”。 這兩種說法雖然一字不同,但含義卻不同。 前者是指氫氣的可燃性(化學性質); 后者是指氫發生化學變化的現象。 需要注意的是,燃燒只是一種現象,不是化學性質,兩者不能混為一談。
判斷一個變化是化學變化還是物理變化,是根據是否產生新物質來判斷的。 物理變化的本質是:組成物質的分子或其他粒子不發生變化,因此不會產生新的物質; 化學變化(化學反應)的本質是:物質分子被破壞,分裂成原子等粒子,原子和其他粒子重新組合,生成新物質,但原子或離子的種類、數量和質量發生變化反應前后沒有變化。
