

中考數學專題講堂之八熱學專題主講人:焦文龍中國人民學院力學專題-四個問題1。分子動理論熱和功2。理想二氧化碳狀態多項式3。二氧化碳試驗定理4。力學綜合第一個問題分子動理論重點的知識:分子動理論的要點和能量轉化和守恒定理.重點的方式:構建數學模型進行推理和估算的方式.難點:有關分子力和分子勢能的概念,以及用能量守恒的觀點去剖析實際問題.思索一力學的基礎理論的主要內容是哪些?微觀角度:分子動理論1.物質是由大量分子組成的.2.分子總處在永不停歇的無規則運動中,稱之為分子熱運動.3.分子間同時存在著互相作用的作用力和引力.宏觀角度:能量轉化和守恒定理具體應用到力學問題的是包括物體內能的熱力學第一定理,提供了從宏觀角度研究力學問題的理論基礎.它表明,從分子動理論出發可以得到對應于分子運動存在著一種新方式的能,即物體的內能.物體的內能改變,可以通過做功和熱傳遞來實現,并遵循熱力學第一定理.思索二請簡略說明布朗運動的形成過程?顯微鏡下連續的液體,實際上是由大量的分子組成的,這些做無規則熱運動的分子,對漂浮在液體中的固體微粒不斷地碰撞,使固體微粒遭到各方向液體分子的力道.在某剎那間,因為固體微粒的容積很小,各方向遭到的液體分子的力道不平衡,其合力形成加速度.而不同時刻力道的合力方向朝向哪些方向具有碰巧性,且不斷變化,這樣,就使固體微粒形成了無規則運動,稱之為布朗運動.思索三哪些是熱運動中的統計規律?布朗運動是跟固體微粒的容積有關的.當微粒較大時,液體分子對固體微粒的碰撞形成的力道,在每剎那間都是平衡的.只有微粒足夠小時,這些撞擊作用的不平衡才得以表現下來.這就是統計規律的表現.思索四請列舉力學中屬于描述大量分子整體特點的宏觀量.氣溫物體的內能二氧化碳的容積和浮力氣溫物體的氣溫是物體內部分子熱運動的平均動能的標志,它是一個宏觀量.因而,氣溫是大量分子熱運動的集體表現.是富含統計意義的.首先,物體內部分子熱運動的速度并不是相同的.其中速度非常大的和速度非常小的分子數量極少,而多數分子的速度處于中間一個范圍內.只有它們的平均速度分子勢能,以及由此決定的平均動能與氣溫有確定的關系.因而,對某些分子談體溫的高低是沒有意義的.氣溫只對大量分子有意義.物體的內能分子動能和分子勢能.所謂“分子動能”是指物體內所有分子因為熱運動決定的分子的動能的和.“分子勢能”是指物體內所有分子因為分子間互相作用的分子力和相對位置決定的勢能的總和.而“物體的內能”則是這兩者之和.其實,對某些分子談內能是沒有意義的.二氧化碳的容積和浮力二氧化碳的容積是指氨氣內所有分子所占有的空間的總和.它應等于所有二氧化碳分子本身占有的空間和它們的間隙的總和.一般二氧化碳的容積是指二氧化碳所飽含的容器的體積.而二氧化碳分子間縫隙常常比二氧化碳分子本身占有的空間大得多.理想二氧化碳的容積就是在忽視分子本身占有的容積的情況下得到的.其實,談某些二氧化碳分子的容積對于研究二氧化碳的性質是沒有意義的.而二氧化碳的浮力是大量二氧化碳分子碰撞器壁的宏觀表現.談某些分子對器壁的浮力是沒有意義的.思索五請簡略說明分子力和分子勢能是怎樣隨分子寬度變化的關于分子力的變化規律:分子勢能的變化規律:關于分子力的變化規律1.分子間同時存在著互相作用的引力和作用力.2.分子間的引力和作用力都隨分子寬度的減小而降低,隨分子寬度的減少而減小.但作用力比引力變化得快.3.分子間互相作用的引力和作用力的合力稱為分子力.分子力為零的位置稱為平衡位置,r0=10-10m.當分子寬度小于平衡位置時,分子力表現為引力,直到寬度超過10-9m減少到零為止.當分子寬度大于平衡位置直到不能再小時,分子力表現為作用力.分子勢能的變化規律1.當分子力表現為引力時,分子勢能隨分子寬度的減小而減小;當分子力表現為作用力時,分子勢能隨分子寬度的減小而降低.2.分子勢能存在一個最高點,即在平衡位置處.注意!1.分子力實質上是一種電磁作用.可以利用于原子的靜電模型加以簡略說明,在兩個原子接近時,其原子核之間、電子云之間的靜電力表現為作用力;而原子核和電子云之間的靜電力則表現為引力.它們大小的變化造成了合力的變化.2.假若取平衡位置為分子勢能的零點.則分子勢能是非負值.雖然是分子寬度小于10-9m,分子力為零時,分子勢能也小于零.這是由于,比較兩個位置分子勢能高低的基本技巧是:看分子力做功.假若從某一位置移到另一位置分子力做正功,則分子勢能降低;若分子力做負功,則分子勢能降低.其實,從平衡位置出發,無論寬度減小還是減輕.分子力都做負功分子勢能,分子勢能都變大.3.由分子勢能形成的條件可以看出:分子勢能跟重力勢能和彈性勢能相比,是不同性質的能,它不屬于機械能的范疇.這么,分子動能和物體的內能跟機械能屬于同一范疇嗎?思索六物體的內能和機械能之間主要區別1.對應著不同的研究對象和化學運動方式.機械能對應于宏觀物體的機械運動,而物體的內能對應于大量分子的熱運動,是大量分子的集體表現,是統計平均的結果.2.對應著不同的互相斥力.機械能對應于萬有引力和彈簧彈力;而物體的內能對應于靜電力.3.數值的確定根據和技巧不同.思索七內能改變的化學過程有什么?都發生了哪些方式的能之間的轉化?轉化遵守哪些規律?1.物體內能的改變可以通過做功和熱傳遞來實現.做功是其他方式的能跟物體內能互相轉化的過程;而熱傳遞只是內能的轉移,沒有能量方式的轉化.2.物體內能的改變遵守能量守恒定理.具體方式由熱力學第一定理表示為△E=W+Q.其中△E表示內能的改變量,W表示做的功,Q表示傳遞的熱量.熱力學第一定理把內能的變化和改變它的兩種化學過程定量化,為我們分析問題和解決問題提供了定量關系.例題1如圖2-3-1所示的容器中,A、B各有一個可自由聯通的輕活塞,活塞下方是水,上方為空氣,大氣壓恒定.A、B頂部由帶有球閥K的管線相連,整個裝置與外界絕熱.原本A中海面比B中高,打開球閥,使A中的水漸漸向B中流,最后達到平衡.在這個過程中,下邊那個說法正確?A.大氣壓力對水做功,水的內能降低B.水克服大氣壓力做功,水的內能減低C.大氣壓力對水不做功,水的內能不變D.大氣壓力對水不做功,水的內能降低解析1.確定研究對象.本題中是連通器中的水(系統).2.剖析系統與外界環境的關系.因為涉及系統內能是否變化,所以應從熱傳遞和做功兩個方面進行.(1)由題中給出的條件可知:整個裝置與外界絕熱,所以不發生熱傳遞.(2)同時,連通器中的水應遭到連通器壁和器底的彈力,大氣通過活塞施加的大氣壓力,以及因為整個系統在地面而遭到的重力逐一判別各力的做功情況可知連通器對水的斥力,因無宏觀位移或位移與力的方向垂直而對水不做功.再看大氣壓力的功.打開球閥K后,按照連通器原理,最后A、B兩管中的海面相平.設A管的橫截面積為S1,海面下滑的高度為h1,B管的橫截面積為S2,海面上升的高度為h2.如圖2-3-2所示.因為水的總體積保持不變,故有S1h1=S2h2.A管中的水受向上的大氣壓力升高,大氣壓力做正功為W1=.B管中的水遭到向上的壓力,但海面上升,大氣壓力做負功為W2=-.則大氣壓力對水所做的總功W=W1+W2=0.即大氣壓力對水不做功.至于重力對水所做的功,如圖2-3-2可以看見:水從A管流到B管,最后海面相平,最終的療效是A管中高度為h1的火柱移到B管中成為高度為h2的火柱,其重心的高度增長,為此,在這個過程中水所受重力對水做正功.據熱力學第一定理:△E=W+Q可知:水所受各力的合功為正功,傳遞的熱量為零,所以,水的內能應降低.故應選D.小結對于有關系統內能變化的問題,應按照熱力學第一定理,仔細剖析系統所受外力做功和熱傳遞的情況,綜合運用各方面的知識,有步驟地求解.第二個問題理想二氧化碳狀態多項式三個熱阻:PVT核心公式:PV/T=nR其中n為物質的量R為一常量思索一哪些二氧化碳可以看做是理想二氧化碳?能嚴格遵循二氧化碳實驗定理的二氧化碳.浮力不太大、溫度不太低(常溫、常壓)的實際二氧化碳.理想二氧化碳的內能理想二氧化碳的分子間斥力為零,分子勢能為零,所以理想二氧化碳的內能等于分子動能.那么決定一定質量的某種理想二氧化碳的內能的宏觀標志是哪些?氣溫T幾個等值變化過程(1)絕熱過程.(2)等溫過程.(3)等容過程.(4)等壓過程.絕熱過程絕熱通常指封閉二氧化碳的材料絕熱或過程完成得迅速,此過程的特征是熱量Q=0,這么朋友們可以討論當一個絕熱汽缸內的二氧化碳向外膨脹的過程中,二氧化碳的內能怎樣變化?二氧化碳的氣溫怎樣變化?當一個絕熱汽缸內的二氧化碳向外膨脹的過程中,二氧化碳的容積變大,二氧化碳對外做功,又由于是絕熱過程,二氧化碳既不放熱也不向外界吸熱,依據熱力學第一定理,其內能減少,二氧化碳的濕度增加.等溫過程等溫過程中二氧化碳的體溫保持不變,所以其內能不變.這么當一定質量的理想二氧化碳的浮力減小,系統是放熱還是吸熱?由于是等溫過程,所以系統的內能不變;按照玻-馬定理,當二氧化碳浮力減小時,二氧化碳的容積變小,外界對二氧化碳做功;依據熱力學第一定理,系統向外界吸熱.等容過程等容過程的特征是哪些?這么當一定質量的理想二氧化碳的浮力減小,系統是放熱還是吸熱?容積不變,所以做功W=0;按照查理定理,二氧化碳的浮力減小,則體溫下降,內能變大;依據熱力學第一定理,系統從外界放熱.等壓過程等壓過程的特征是哪些?這么當一定質量的理想二氧化碳的容積減小,系統是放熱還是吸熱?浮力不變,按照蓋·呂薩克定理,二氧化碳的容積減小,則體溫下降,內能變大;又由于二氧化碳的容積變大,二氧化碳對外界做功;依據熱力學第一定理,系統從外界放熱.例題2圖2-2-5中A、B兩點表示一定質量的某種理想二氧化碳的兩個狀態.當二氧化碳自狀態A變化到狀態B時A.容積必然減小B.有可能經歷容積增大的過程C.外界必然對二氧化碳做正功D.二氧化碳必然從外界放熱解析1。
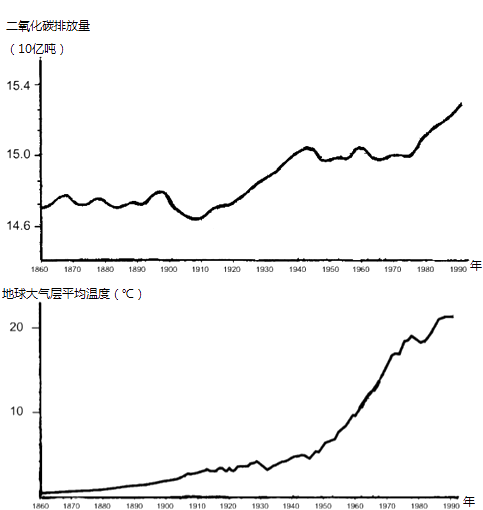
當二氧化碳自狀態A變化到狀態B時,能夠依照圖線判定二氧化碳的容積怎樣變化?能.在p-T圖線中斜率的大小反映了二氧化碳的容積的變化.分別過A、B兩點做過原點的斜直線,從圖中可知,VB>VA.2。二氧化碳的浮力減少,而氣溫卻下降,按照理想氣體狀態多項式,也可以判斷二氧化碳的容積必然變大,而且能夠判定二氧化碳從A到B的整個變化過程中二氧化碳的容積仍然變大嗎?不能排除過程中有容積增大的某一小段過程.3。這么怎樣判別二氧化碳是否對外做功,以及二氧化碳吸、放熱的情況?從總的變化上看,二氧化碳的容積還是變大了的,所以二氧化碳對外界做正功,又由于二氧化碳的氣溫下降,內能降低,依據熱力學第一定理,二氧化碳應從外界放熱.正確答案應選A、B、D第三個問題二氧化碳試驗定理二氧化碳的三個實驗定理創立的條件是哪些?(1)一定質量的二氧化碳,浮力不太大,氣溫不太高時.(2)控制變量的方式.對一定質量的某種二氧化碳,其狀態由p、V、T三個熱阻來決定,倘若控制T不變,研究p-V間的關系,即得到玻-馬定理;倘若控制V不變,研究p-T間的關系,即得到查理定理;倘若控制p不變,研究V-T間的關系,即得到蓋·呂薩克定理.等溫過程——玻-馬定理(1)內容:一定質量的某種二氧化碳,在室溫不變時,浮力和容積的乘積是恒量.(2)表達式:p1V1=p2V2(3)圖象:等容過程——查理定理(1)內容:一定質量的二氧化碳,在容積不變的情況下,氣溫每下降(或減少)1℃,降低(或降低)的浮力等于它0℃時浮力的1/273.一定質量的氣體,在容積不變的情況下,它的浮力和熱力學溫標成反比.等壓變化——蓋·呂薩克定理(1)內容:一定質量的二氧化碳,在浮力不變的情況下,它的容積和熱力學溫標成反比.(2)表達式:例題三[例3]一個質量不計的活塞將一定量的理想二氧化碳封閉在上端開口的直立筒形汽缸內,活塞上堆滿著鐵砂,如圖2-1-8所示.最初活塞擱置在汽缸內壁的卡環上,氣柱的高度H0,浮力等于大氣浮力p0.現對二氧化碳平緩加熱,當氣體氣溫下降了△T=60K時,活塞(及鐵砂)開始離開卡環而上升.繼續加熱,直至氣柱高度H1=1。
5H0.隨后在維持體溫不變的條件下漸漸拿走鐵砂,直至鐵砂被全部拿走時,氣柱高度變為H2=1。8H0.求此時二氧化碳的體溫(不計汽缸和活塞間的磨擦).剖析以封閉在汽缸內的一定質量的理想二氧化碳為研究對象,(1)從最初活塞擱置在汽缸內壁的卡環上,到當二氧化碳氣溫下降了△T=60K時,活塞(及鐵砂)開始離開卡環這一過程二氧化碳的那個狀態熱阻沒有發生變化?(2)從當二氧化碳氣溫下降了△T=60K時,活塞(及鐵砂)開始離開卡環而上升,直至氣柱高度H1=1。5H0.這一過程二氧化碳的那個狀態熱阻沒有發生變化?(3)隨后的過程二氧化碳的那個狀態熱阻沒有發生變化?回答完前面的三個問題后,相信朋友們就能自己解答出此題了.(1)容積不變,所以此過程為等容變化.(2)浮力不變,所以此過程為等壓變化.(3)氣溫不變,所以此過程為等溫變化.解法一以封閉在汽缸內的一定質量的理想二氧化碳為研究對象,設最初活塞擱置在汽缸內壁的卡環上時,二氧化碳的氣溫為T0,二氧化碳的浮力為p0,容積為V0=H0S,則活塞(及鐵砂)開始離開卡環時的氣溫T1=T0+△T,二氧化碳的浮力為p1,容積為V1,由于等容變化,V1=V0,按照查理定理,設氣柱高度為H1時,二氧化碳氣溫為T2,容積為V2=H1S,浮力為p2,由于是等壓變化,p2=p1,按照蓋·呂薩克定理,設氣柱高度為H2時,二氧化碳氣溫為T3,容積為V3=H2S,浮力為p3,由于鐵砂全部拿走時p3=p0,又由于是等溫變化,T3=T2,按照玻-馬定理,p3V3=p2V2,p0H0=p1H1(3)由(1)、(3)兩式解得:由(2)、(4)兩式解得:由(5)、(6)兩式解得:解法二以封閉在汽缸內的一定質量的理想二氧化碳為研究對象,設最S初活塞擱置在汽缸內壁的卡環上時,二氧化碳的氣溫為T0,則活塞(及鐵砂)開始離開卡環時的氣溫為T0+△T,設氣柱高度為H1時,氣體氣溫為T1,氣柱高度為H2時,二氧化碳氣溫為T2,由等壓過程得由初態和末態的浮力相等,得由(1)、(2)兩式解得:汽缸內的封閉二氧化碳先后經歷了四個狀態、三個過程.可以構建如右圖景:借助上述圖景,可以使復雜的過程清晰詮釋,所以剖析化學圖景是解題十分關鍵的步驟.第四個問題熱綜合在力熱綜合問題中,主要選封閉二氧化碳及封閉二氧化碳的活塞或液柱為研究對象.對于封閉二氧化碳,可以按照過程特點選用二氧化碳定理構建多項式.對于活塞或液柱,可依照運動狀態由平衡條件或牛頓第二定理構建多項式.這兩個等式的聯系在于二氧化碳的浮力與活塞受力.二氧化碳浮力是熱學規律和力學規律之間聯系的橋梁.實際問題中,有按照二氧化碳狀態確定活塞或液柱的運動狀態,也有依照活塞或液柱的運動狀態來確定二氧化碳狀態,這是力熱綜合的集中彰顯,通過浮力這個數學量構建聯系,因而達到綜合的目的.而二氧化碳狀態和活塞或液柱運動狀態的確定容易產生難點,也是中學生容易出錯的地方,與此相關,也會引出與二氧化碳容積有聯系的幾何問題.力熱綜合例題水平放置的直玻璃管長為L,一端封閉,管中處有一質量為m的薄活塞將管中的空氣與外界隔開,如圖2-4-1所示,薄活塞可在管中聯通,與管壁的磨擦不計.當直玻璃管繞開管口的豎直軸以角速率ω轉動時,管中的活塞正好坐落管中央,倘若將轉動的角速率提升到2ω,則薄活塞將在管中聯通多大距離?解析1.在本題中,二氧化碳容積是幾何量,同時,活塞做圓周運動的直徑也是幾何量,聯通距離既彰顯在初、末態容積的變化上,也彰顯在活塞做圓周運動直徑的變化上.2.按基本步驟解題(1)確定研究對象.活塞、封閉二氧化碳.(2)確定二氧化碳變化過程:等溫變化.取活塞在管中央為初態,以角速率提升之后活塞位置為末態.怠速提升之后,活塞向哪一端聯通?為何?初態浮力:以活塞為研究對象,受力剖析(圖2-4-2),初態容積:l和S是未知數.一個多項式,兩個未知數,還須要一個多項式.末態浮力:設二氧化碳聯通距離為l,活塞向封閉端聯通.圖2-4-3所以:pV=p′V′再確定二氧化碳變化過程,構建另一個氣態多項式,挖掘題給條件.以活塞在管口處為初態,活塞在管中央為末態.初態浮力:p0容積:L·S(3)聯立多項式解多項式組.①、②兩式聯立,解得小結在本題中,確定二氧化碳的變化過程,正確選定初末態是關鍵也是主線,在此基礎上,剖析初末態活塞運動狀態和受力情況對完善氣態多項式起輔助作用,但是二氧化碳變化過程的初末態也同時是對活塞進行受力剖析的狀態,因此,剖析二氧化碳變化過程和選定二氧化碳狀態構建氣態多項式對解題起關鍵作用.通過本題熟悉解力熱綜合問題的通常技巧,學會從氣態多項式和運動多項式入手,正確選定二氧化碳變化過程和狀態,構建氣態多項式,對活塞受力剖析,構建運動多項式,聯立多項式求解.處理力熱綜合問題的通常方式1.確定研究對象,通常取封閉二氧化碳和液柱或活塞.2.狀態剖析并列多項式.正確確定二氧化碳的變化過程特點,是等溫、等壓還是等容或通常變化過程,并正確選定二氧化碳變化的初末態,找出二氧化碳狀態熱阻,構建氣態多項式.對活塞或液柱進行受力剖析和運動狀況剖析,依據牛頓第二定理列運動等式或平衡多項式.3.按照活塞上力與浮力的關系聯立多項式并解多項式組.通常情況下,力熱綜合問題可以歸為兩類:1.力——→壓強——→氣體狀態熱阻(容積、溫度等)及其相關化學量2.二氧化碳狀態熱阻——→壓強——→力及其相關化學量(如質量、加速度等)浮力作為聯系力和熱的橋梁既可以由熱學方式來確定,也可以由氣態多項式來確定.這些處理數學問題的思想也可以推廣到其他綜合性問題.確定不同研究對象,針對不同的變化過程和狀態列對應等式,通過數學量構建起各多項式的聯系,構建各化學過程的聯系.*天津師范學院京師大樓9810室電話:傳真:*