

點擊訂購劉叔專著《高中化學指南》
阿莫迪歐·阿伏伽德羅
在數學學和物理中,阿伏伽德羅常數(符號:
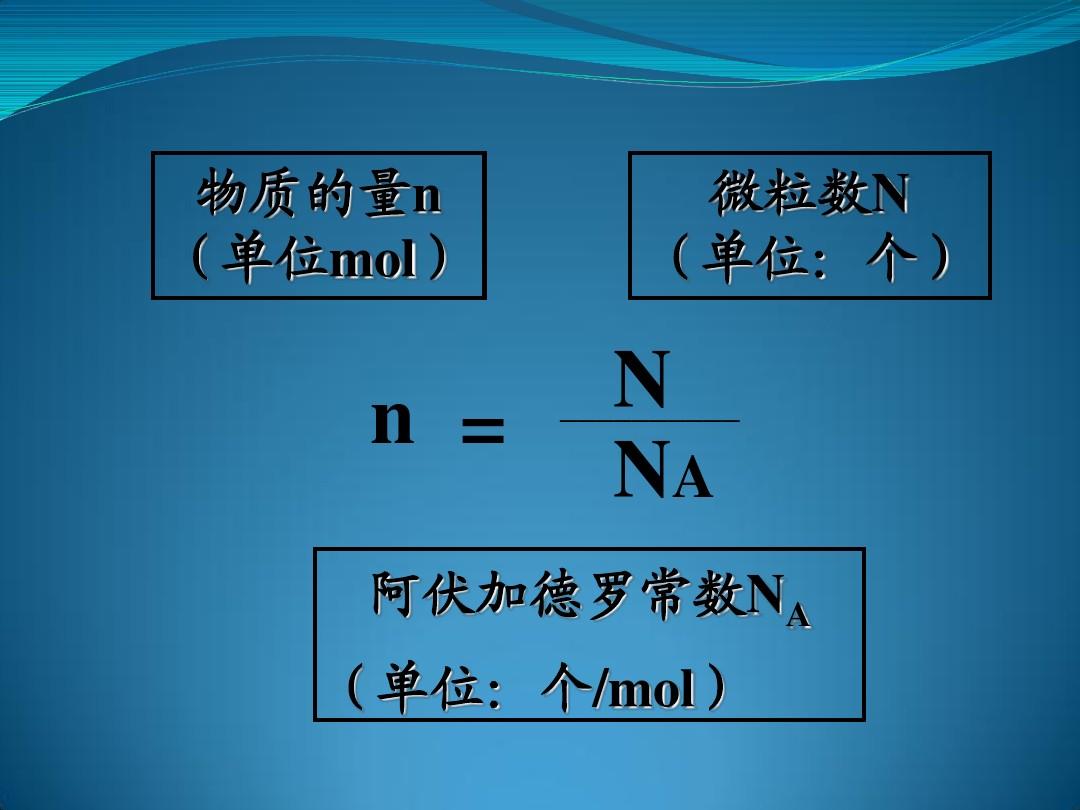
)的定義是一個比值,是一個樣本中所含的基本單元數(通常為原子或分子)N與它所含的物質量n(單位為摩爾)間的比值,公式為
。因而,它是聯系一種粒子的摩爾質量(即一摩爾時的質量),及其質量間的比列常數。阿伏伽德羅常數用于代表一摩爾物質所含的基本單元(如分子或原子)之數目,而它的數值為:
在通常估算時,常取6.02×1023或6.022×1023為近似值。

較早的定義中所訂的另一個數值為阿伏伽德羅數,歷史上這個詞與阿伏伽德羅常量有著密切的關系。當國際單位制(SI)修訂了基本單位后,所有物理數目的概念都必需被重定義。阿伏伽德羅數的新定義由讓·佩蘭所下,定為一克原子氫所含的分子數。跟它一樣的是,12克核素碳-12所含的原子數目。為此,阿伏伽德羅數是一個無量綱的數目,與用基本單位表示的阿伏伽德羅常量數值一致。科學家還在不斷精確化阿伏伽德羅常數,最新的研究論文發覺其數值為6.(74)×1023,括弧中的數字表示最后兩位市值數字的不確定性。
阿伏伽德羅常數因阿莫迪歐·阿伏伽德羅得名,他是一名19世紀初期的英國物理家,在1811年他率先提出,二氧化碳的容積(在某氣溫與壓力下)與所含的分子或原子數目成反比,與該二氧化碳的性質無關。日本化學學家讓·佩蘭于1909年提出阿伏伽德羅常數公式,把常數命名為阿伏伽德羅常量來記念他。佩蘭于1926年獲頒諾貝爾化學學獎,他研究一大課題就是各類量度阿伏伽德羅常量的方式。
阿伏伽德羅常量的值,最早由法國物理及化學學家約翰·約瑟夫·洛施米特(Josef)于1865年所得阿伏伽德羅常數公式,他透過估算某固定容積二氧化碳內所含的分子數,成功恐怕出空氣短發子的平均半徑。后者的數值,即理想二氧化碳的數目密度,叫“洛施米特常數”,就是以他命名的,這個常數大概與阿伏伽德羅常量成反比。因為阿伏伽德羅常量有時會用L表示,所以不要與洛施米特()的L混淆,而在英語文獻中可能時會把它們都叫作“洛施米特常數”,只能用計量單位來區分提到的究竟是哪一個。
要確切陽線度出阿伏伽德羅常量的值,須要在宏觀和微觀尺度下,用同一個單位,去量度同一個數學量。這樣做在早年并不可行,直至1910年,羅伯特·密立根成功量度到一個電子的電荷,才才能利用單個電子的電荷來做到微觀量度。一摩爾電子的電荷是一個常數,別稱拉第常數,在麥可·法拉第于1834年發表的電解研究中有提到過。把一摩爾電子的電荷,減去單個電子的電荷,可得阿伏伽德羅常量。
中學數學知識點總結