共價鍵的極性分子間斥力1.下述化合物中,物理鍵的類型和分子的極性(極性或非極性)皆相同的是()A.CO2和SO2B.CH4和PH3C.BF3和NH3D.HCl和HI2.下述關于范德華力的表述中正確的是()A.是一種較弱的物理鍵B.分子間的范德華力越大,分子就越穩定C.相對分子質量相同的分子之間的范德華力也相同D.稀有二氧化碳的原子間存在范德華力3.下述事實不可以用構象來解釋的是()A.水是一種十分穩定的化合物B.檢測氯化氫相對分子質量的實驗中,發覺實驗值總是小于20C.水締結冰后,容積膨脹,密度變小D.氣體容易液化4.下述說法正確的是()A。分子中只有極性鍵B.CH4分子中富含極性共價鍵,是極性分子C.CO2分子中的物理鍵為非極性鍵D.CH4和CO2分子中碳原子的介孔類型分別是sp3和sp5.甲醛()在Ni催化作用下制氫可得乙醇(CH3OH),以下說法中正確的是()A.甲醛分子間可以產生構象B.甲醛分子和乙醇分子中C原子均采取sp2介孔C.甲醛為極性分子D.乙醇的沸點遠高于甲醛的沸點6.ⅤA族元素絡合物RH3(NH3、PH3、AsH3)的某種性質隨R的核電荷數的變化趨勢如圖所示,則Y軸可表示的是()A.相對分子質量B.穩定性C.沸點D.R-H鍵長7.關于官能團,下述說法正確的是()A.分子中有N、O、F原子,分子間就存在電負性B.由于電負性的緣故,比熔、沸點高C.因為電負性比范德華力強,所以HF分子比HI分子穩定D.“可燃冰”——甲烷水合物(比如:8CH4·46H2O)中CH4與H2O之間存在電負性8.甲基化二硫(S2Cl2)為非平面結構,常溫下是一種黃綠色液體,有剌激性臭味,熔點80℃,沸點135。
6℃,對甲基化二硫表述正確的是()A.甲基化二硫的電子式為B.分子中既有極性鍵又有非極性鍵C.甲基化二硫屬于非極性分子D.分子中S-Cl鍵能大于S-S鍵的鍵能9.下述物理反應中,既有離子鍵、極性鍵、非極性鍵破裂,又有離子鍵、極性鍵、非極性鍵產生的是()A.+2H2O===4NaOH+O2↑B.Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑C.Cl2+H2O===HClO+HClD.NH4Cl++NH3↑+H2O10.有五個系列同宗元素的物質,101。3kPa時測定它們的沸點(℃)如下表所示:
①He-268.8(a)-249.5Ar-185.8Kr151.7②F2-187.0Cl2-33.6(b)58.7I2184.0③(c)19.4HCl-84.0HBr-67.0HI-35.3④H2O100.0H2S-60.0(d)-42.0H2Te-1.8⑤CH4-161.0SiH4-112.0GeH4-90.0(e)-52.0對應表中內容,下述表述中正確的是()A.a、b、c代表的物理物中均含物理鍵B.系列②物質均有氧化性;
系列③物質對應水堿液均是弱酸C.系列④中各化合物的穩定性次序為:H2O>H2S>H2Se>H2TeD.上表中物質HF和H2O,因為官能團的影響,其分子非常穩定11.右圖中A、B、C、D四條曲線分別表示第ⅣA、ⅤA、ⅥA、ⅦA族元素絡合物的沸點,其中表示第ⅥA族元素絡合物沸點的是曲線;
表示第ⅣA族元素絡合物沸點的是曲線。同一族中第三、四、五周期元素的絡合物的沸點依次下降,其緣由是____。A、B、C曲線中第二周期元素的絡合物的沸點明顯低于第三周期元素絡合物的沸點,其緣由是。
12.已知和碳元素同主族的X元素坐落元素周期表中的第一個長周期,短周期元素Y原子的最內層電子數比外層電子總量少3,它們所產生化合物的分子式是XY4。回答下述問題:
(1)X元素原子的能級電子排布式為,Y元素原子最內層電子的電子排布圖為。
(2)若X、Y兩元素的化合價分別為1.8和3.0,試判定XY4中X與Y之間的物理鍵為(填“共價鍵”或“離子鍵”)。
(3)化合物XY4的立體構象為,中心原子的介孔類型為,該分子為(填“極性分子”或“非極性分子”)。
13.(1)銅與類鹵素(SCN)2反應生成Cu(SCN)2,1mol(SCN)2中富含π鍵的數量為;
類鹵素(SCN)2對應的酸有兩種,理論上硫氰酸(H—S—C≡N)的沸點高于異硫氰酸(H—N===C===S)的沸點,其緣由是__。
(2)H2O2與H2O可以任意比列互溶,不僅由于它們都是極性分子外,還由于。
(3)乙二胺(H2N—CH2—CH2—NH2)與CaCl2氨水可產生配離子(結構如圖),乙二胺分子中氮原子的介孔類型為;
乙二胺和三甲胺[N(CH3)3]均屬于胺,但乙二胺比三甲胺的沸點高得多,緣由是。
(4)二氧化硫溶于水時,大部份NH3與H2O以絡合物(用“…”表示)結合產生NH3·H2O分子。按照溶液的性質可推知NH3·H2O的結構式為。
(5)在元素周期表中氟的氫鍵最大,用構象表示式寫出HF水氨水中存在的所有構象:。
14.水是自然界中普遍存在的一種物質,也是維持生命活動所必需的一種物質。右圖為冰的結構回答下述問題:
(1)s軌道與s軌道重疊產生的共價鍵可用符號表示為ds-s,p軌道以“頭碰頭”方式重疊產生的共價鍵可用符號表示為dp-p,則H2O分子中富含的共價鍵用符號表示為。
(2)1mol冰中有“氫鍵”。
(3)已知:2H2O===H3O++OH-,H3O+的立體構象是,H3O+中富含一種特殊的共價鍵是。
(4)依據等電子原理,寫出短周期元素原子產生的與H3O+互為等電子體的分子或離子。
(5)科學家發覺在特殊條件下,水能表現出許多種有趣的結構和性質①一定條件下給水施加一個弱電場,常溫常壓下水締結冰,也稱“熱冰”,其計算機模擬圖如下:
使水締結“熱冰”采用“弱電場”的條件,說明水分子是分子(填“極性”或“非極性”)。
②用高能射線照射液態水時,一個水份子能釋放出一個電子,同時形成一種陽離子。形成的陽離子具有較強的氧化性,試寫出該陽離子與SO2的水氨水反應的離子方程式;
該陽離子能夠與水作用生成甲基,經測定此時的水具有堿性,寫出該過程的離子方程式。
(6)水的分解氣溫遠低于其沸點的緣由是。
(7)從結構的角度剖析固態水(冰)的密度大于液態水的密度的緣由是。
課時作業81.答案:D2.答案:D3.解析:官能團影響物質的部份化學性質,穩定性屬于物理性質,即水是穩定的化合物與電負性無關,故A符合題意;
HF分子間存在電負性,使HF聚合在一起,產生(HF)n,因而檢測氯化氫相對分子質量的實驗中,發覺實驗值總是小于20,與電負性有關,故B不符合題意;
水結冰,產生分子間官能團,使容積膨脹,密度變小,故C不符合題意;
氣體分子間存在電負性,使氣體熔沸點下降,即氣體易液化,故D不符合題意。
答案:A4.解析:同種原子產生的共價鍵是非極性鍵,即C===C鍵是非極性鍵,A錯誤;
在CH4分子中富含C—H極性共價鍵,因為該分子中各個共價鍵空間排列對稱,是正多面體形的分子,所以該分子是非極性分子,B錯誤;
氣體結構為O===C===O,為極性鍵,C錯誤;
CH4分子中碳原子產生的都是σ鍵,碳原子的介孔類型是sp3介孔,而CO2分子中碳原子與兩個氧原子分別產生了兩個共價鍵,一個σ鍵、一個π鍵,碳原子的介孔類型是sp介孔,D正確。
答案:D5.解析:甲醛分子中與H產生共價鍵的C原子的官能團沒有這么大,與其相連的H原子不會成為“裸露”質子,甲醛分子間不存在電負性,A項錯誤;
甲醛中C原子產生3個σ鍵和1個π鍵,C上沒有孤電子對,其中C為sp2介孔,乙醇分子中C原子產生4個σ鍵,C上沒有孤電子對,其中C為sp3介孔,B項錯誤;
甲醛分子為平面三角形,分子中正負電中心不重合,是極性分子,C項正確;
乙醇分子中有—OH,可以產生分子間官能團,乙醇的沸點比甲醛的沸點高,D項錯誤。
答案:C6.解析:NH3、PH3、AsH3的相對分子質量逐步減小,與圖示曲線不相符,故A項錯誤;
元素的非金屬性越強,其絡合物越穩定,非金屬性N>P>As,所以絡合物的穩定性隨著原子序數減小而減慢,故B項正確;
絡合物的熔沸點與其相對分子質量成反比,但富含官能團的熔沸點最高,所以沸點高低次序是NH3、AsH3、PH3,故C項錯誤;
原子直徑越大,R-H鍵長越長,原子直徑N<P<As,所以鍵長由短到長的次序為NH3、PH3、AsH3,故D項錯誤。
答案:B7.解析:非金屬性較強的元素N、O、F的絡合物易產生構象,并不是分子中有N、O、F原子分子間就存在電負性,如NO分子間就不存在電負性,故A項錯誤;
若產生分子內官能團時,其熔點和沸點會增加,產生分子間絡合物時,物質的熔點和沸點都會下降,產生分子間官能團分子間作用力,產生分子內官能團,故熔沸點高,故B項正確;
分子的穩定性和構象是沒有關系的,而與物理鍵有關系,故C項錯誤;
C-H鍵極性十分弱,不可能與水份子產生構象。干熱巖是由于高壓下水分子通過構象產生籠狀結構,籠狀結構的容積與氫氣分子相仿,正好可以容納下二氧化碳分子,而二氧化碳分子與水份子之間沒有構象,故D項錯誤。
答案:B8.解析:S2Cl2分子中S原子之間產生1對共用電子對,Cl原子與S原子之間產生1對共用電子對,結合分子結構可知S2Cl2的結構式為Cl-S-S-Cl,電子式為,故A項錯誤;
S2Cl2中Cl-S鍵屬于極性鍵,S-S鍵屬于非極性鍵,不對稱的結構,為極性分子,故B項正確;
分子的結構不對稱,為極性分子,而不是非極性分子,故C項錯誤;
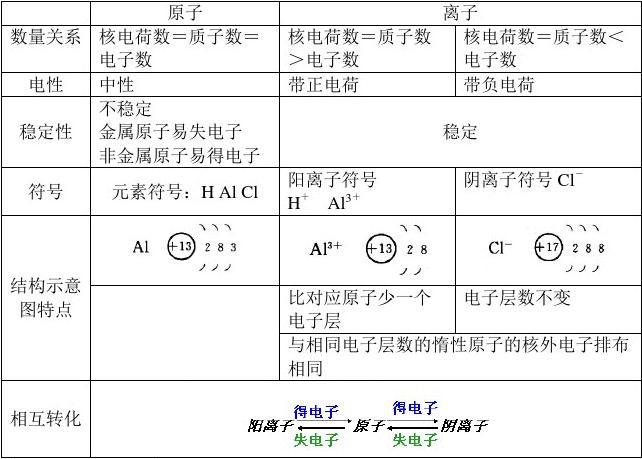
同周期從左向右原子直徑逐步減少,所以氯原子直徑大于硫原子直徑,鍵長越短鍵能越大,所以分子中S-Cl鍵能小于S-S鍵的鍵能,故D項錯誤。
答案:B9.答案:A10.解析:He、Ne、Ar、Kr是同一主族元素的原子,按照遞變次序,可知a為Ne;
F、Cl、Br、I屬于同一主族元素的原子,且b應是單質方式,即為Br2,c為絡合物,即HF,則a、b、c的物理式分別為Ne、Br2、HF,稀有二氧化碳無任何物理鍵分子間作用力,A項錯誤;
鹵素單質均表現為較強的氧化性,對應的絡合物中苯酚是強酸,B項錯誤;
O、S、Se、Te的原子的得電子能力依次減小,非金屬性越來越弱,則絡合物的穩定性越來越弱,系列④中各化合物的穩定性次序為:H2O>H2S>H2Se>H2Te,C項正確;
官能團影響化學性質,分子的穩定性與共價鍵的強弱有關,與電負性無關,D項錯誤。
答案:C11.解析:組成和結構相像的絡合物,其相對分子質量越大,分子間斥力越大,沸點越高。為此,同一主族元素產生的絡合物的沸點按從上到下逐步遞增的趨勢。并且因為H2O、HF、NH3分子間存在電負性,分子間斥力明顯減小,因此沸點明顯下降。
答案:AD同宗元素的絡合物相對分子質量越大,分子間斥力越大,沸點越高H2O、HF、NH3分子間存在電負性,分子間斥力明顯減小,因此沸點明顯下降12.解析:(1)按照題意可推出,X為第四周期第IVA族元素Ge,其核外電子排布式為s24p2或[Ar],Y元素原子的最內層電子數比外層電子總量少3,則Y是氯,Y元素原子最內層電子的電子排布圖為。(2)因X、Y兩元素化合價的差值為3.0-1.8=1.2
答案:(1)s24p2(或[Ar])(2)共價鍵(3)正多面體形sp3介孔非極性分子13.解析:(1)(SCN)2的結構式為N≡C—S—S—C≡N,單鍵為σ鍵,三鍵中富含1個σ鍵、2個π鍵,故1mol(SCN)2中富含π鍵的數量為4NA;
異硫氰酸分子間可產生構象,而硫氰酸不能,故異硫氰酸的沸點較高。
(2)H2O2與H2O分子間可以產生構象,溶化度減小,引起兩者之間互溶。
(3)乙二胺(H2N—CH2—CH2—NH2)中N原子產生3個σ鍵,含1對孤電子對,價層電子對數為4,采取sp3介孔;
乙二胺(H2N—CH2—CH2—NH2)分子之間可以產生構象,三甲胺[N(CH3)3]分子之間不能產生構象,故乙二胺的沸點較高。
(4)從官能團的成鍵原理上講,A、B兩項都組建,C、D兩項都錯誤;
然而H—O鍵的極性比H—N鍵的大,H—O鍵上氫原子的正電性更大,更容易與氮原子產生構象,所以官能團主要存在于H2O分子中的H與NH3分子中的N之間。另外,可從熟知的性質加以剖析。NH3·H2O能電離出NH和OH-,按A項結構不能寫出其電離方程式,按B項結構可合理解釋NH3·H2ONH+OH-,所以B項正確。
(5)HF在水氨水中產生的構象可從HF和HF、H2O和H2O、HF和H2O(HF提供氫)、H2O和HF(H2O提供氫)四個方面來考慮。由此可以得出HF水氨水中存在的電負性。
答案:(1)4NA異硫氰酸分子間可產生構象,而硫氰酸不能(2)H2O2與H2O分子之間可以產生構象(3)sp3介孔乙二胺分子之間可以產生構象,三甲胺分子之間不能產生構象(4)B(5)F—H…F、F—H…O、O—H…F、O—H…O14.解析:(1)H原子只有一個電子,且搶占s軌道,O原子通過介孔產生4個sp3介孔軌道,介孔軌道上有2個不成對電子,H原子的s軌道與O原子的sp3介孔軌道頭碰頭產生共價鍵,則H2O分子中富含的共價鍵用符號表示為ds-sp3;
(2)每位水份子與相鄰的4個水份子產生構象,故每位水份子產生的構象數為4/2=2;
(3)H2O的結構為V形,O富含兩對孤電子,H+具有空軌道,可以以配位鍵的方式,結合其中一對孤電子產生H3O+,則該離子的空間結構為三角錐形;
(4)等電子體的要求是原子總量相同,價電子總量相同,所以短周期元素原子產生的與H3O+互為等電子體的分子或離子有NH3;
(5)①在電場作用下的凝結,說明水分子是極性分子;
②由水份子釋放出電午時形成的一種陽離子,可以表示成H2O+,由于氧化性很強,氧化SO2生成鹽酸,2H2O++SO2===4H++SO,依據信息和電荷守恒,H2O++H2O===H3O++-OH,為此,本題正確答案是:
2H2O++SO2===4H++SO,H2O++H2O===H3O++-OH;
(6)水的分解氣溫遠低于其沸點的緣由是水分解須要破壞分子內部的極性鍵,水的氣化只需破壞分子間的范德華力與電負性即可,而極性鍵遠比分子間的范德華力與電負性強得多;
(7)水份子之間不僅范德華力外還存在較強的官能團,電負性是有方向性和飽和性的,水由液態變為固態時,電負性的這些方向性和飽和性表現得更為突出,每位水份子都處于與直接相鄰的4個水份子構成的多面體中心,分子之間的縫隙較大,密度較小。
答案:(1)ds-sp3(2)2(3)三角錐形配位鍵(4)NH3(5)①極性②2H2O++SO2===4H++SOH2O++H2O===H3O++-OH(6)水分解須要破壞分子內部的極性鍵,水的氣化只需破壞分子間的范德華力與電負性即可,而極性鍵遠比分子間的范德華力與電負性強得多(7)水份子之間不僅范德華力外還存在較強的官能團,電負性是有方向性和飽和性的,水由液態變為固態時,電負性的這些方向性和飽和性表現得更為突出,每位水份子都處于與直接相鄰的4個水份子構成的多面體中心,分子之間的縫隙較大,密度較小
