一、簡介:
1細胞質膜資料
1895年,從研究細胞透性得出"細胞膜由連續的糖類物質組成"。
1925年&:用脂單分子膜技術測定細胞膜中脂分子的總面積,提出:"細胞膜是由單層脂分子組成"。
1935年&:從測定膜的表面張力得出細胞膜的"三文治結構模型",即蛋白質-脂-蛋白質。
1959年:用電鏡觀察生物膜提出"單位膜模型",將膜的分子結構與超微機構統一上去
長度:2(暗)3.5(亮)2(暗)=7.5
細胞質膜的主要功能概括如下:
(1)為細胞的生命活動提供相對穩定的內環境;
(2)選擇性的物質運輸,包括代謝底物的輸入與代謝產物的排除,其中伴隨著能量的傳遞;
(3)提供細胞辨識位點,并完成細胞內外信息跨膜傳遞;
(4)為多種酶提供結合位點,使酶促反應高效而有序地進行;
(5)介導細胞與細胞、細胞與基質之間的聯接;
質膜參與產生具有不同功能的細胞表面特化結構。
2膜蛋白
雖植物細胞主要有9種膜脂,而膜蛋白的種類繁雜,多數膜蛋白分子數量較少,但卻賦于細胞膜十分重要的生物學功能。
按照膜蛋白分離的難易及其與脂分子的結合形式,膜蛋白可分為兩大類型:外在膜蛋白、內在膜蛋白。
(1)外在膜蛋白為水溶性蛋白,靠離子鍵或其它較弱的鍵與膜表面的蛋白質分子或脂分子結合,因而只要改變堿液的離子硬度甚至提升體溫就可以從膜上分離出來,膜結構并不被破壞。
(2)內在膜蛋白與膜結合十分緊密,通常講只有用去垢劑()使膜解后才可分離下來。
獲得大量有生物學活性的質膜蛋白對我們變得十分的重要。
附注:使用分級抽提方式獲得的“膜蛋白”中只有極少一部份是具備多跨膜區的整和膜蛋白,膜蛋白,到目前為止,一直是蛋白組學的一個困局,不管采用2-D技術也好,ICAT乃至都還不能有效解決這一問題。
二、蛋白抽提
談及蛋白分離,我們想到:超速離心,鹽析法、超濾法、凝膠過濾法、等電點沉淀法、離子交換層析、親和層析、吸附層析、逆流分溶、酶解法……有時這種方式往往組合到一起對特定的物質進行分離純化。因為蛋白質種類繁雜,不同的蛋白質因為結構和組成的差別,其溶化度也各不相同.按照蛋白質的溶化特點,同時可選擇不同的溶劑提取,分為水堿液提取和有機溶劑提取.
然而針對膜蛋白的提取與細胞質蛋白,核蛋白提取不同之處在于它是嵌在膜中的,水溶性不好,基本方式就是用不同的離心速率除去胞質蛋白等,最后用去污劑把蛋白從膜中釋放下來。膜蛋白分離純化的重要步驟是選擇適當的增溶用表面活性劑,通常常用的有膽絡合物,CHAPS(一種離子去污劑),和等表面活性劑。
1、分離膜蛋白的方式(原則性):
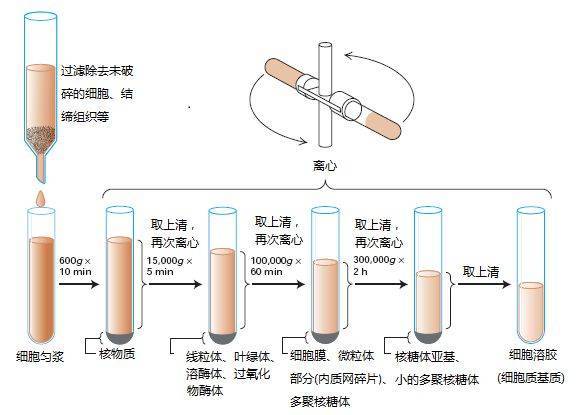
1)先分離膜,之后提取;如選用冷熱交替法、反復凍融法、超聲破碎法、玻璃勻漿法、自溶法和酶處理法促使細胞破碎,之后通過出家離心得到富含膜蛋白的粗組分。(比如:液氮碾磨組織,加入勻漿緩沖液及蛋白酶抑制劑。差速離心。蔗糖密度梯度離心。搜集37%與41%間的成份,即為質膜部份。裂解即可搜集膜蛋白)
2)用特殊的去污劑選擇性的分離。從膜上提取蛋白有許多困難.在多數情況下,都是采用去垢劑將疏水蛋白從其膜結構中溶化出來,之后將蛋白質穩定.去垢劑的選擇一般是根據他對所須要蛋白質的提取效率來確定,但在個別情況下,還要考慮到之后的純化步驟.其實許多膜蛋白必須在去垢劑存在的情況下進行純化,但最終仍可能須要去除去垢劑.
這往往會導致蛋白質失活,但若果蛋白質是用于測序的,他將不是一個問題.倘若不是用于測序的,可考慮使用才能粘附去垢劑的疏水珠.許多文獻和生化試劑供應商的產品目錄中,都介紹有許多種不同的可拿來溶化膜蛋白的去垢劑.但是,她們并不是普遍適用的.在設計膜蛋白溶化方案時,必須考慮某一去垢劑的特殊性質.如X-100在280nm處有吸收,假若某蛋白質的測試與280nm處的吸收有關,就應防止使用這類去垢劑.
將膜劑型與胞質蛋白及細胞核分離后,再進一步從細胞膜劑型上將所需的膜蛋白增溶出來.這些做法的用處是可以用強烈的去垢劑提取細胞骨架的相關蛋白,而無需考慮胞質蛋白、細胞核成份或染色質成份的混進.使用這些方式所獲得的膜蛋白,無論在種類上還是數目上,都比酸溶化法所得到的蛋白(
通常提取的膜蛋白量常常只占膜蛋白總數的不足0.1%,所以充分的膜蛋白的提取,無疑對于研究膜蛋白的結構和功能都是十分重要的.第二種方式簡單,可靠,但有時富含其他蛋白。通常的都是借助4度時所有的蛋白質原則上都溶于水堿液,在氣溫超過20度時,此堿液分為水相和去污相;此時親水性蛋白溶于水相,疏水的膜蛋白溶于去污劑相中。借助此性質可提取膜蛋白。
3)膜蛋白色譜(of,CMP)CMP分離強疏水性蛋白、多肽混和物的層析系統,通常有去垢劑(如SDS)溶化膜蛋白后產生SDS-融膜蛋白,并由甲基磷灰石為固定相的木柱分離純化。甲基磷灰石柱具有陰離子乙酸官能團(P-端),又具有陽離子鈣(C-端),與固定相結合主要決定于膜蛋白的大小、SDS結合量有關。借助原子散射法研究cAMP的分離機制發覺,樣品與SDS結合后在離子交換柱上存在SDS分子、帶電荷多肽與固定相中帶電離子間的交換,進而達到分級分離的目的。
4)次序抽提法:按照細胞蛋白溶化性的差別,器具有不同溶化能力的蛋白溶化液進行抽提的方式。用Tris堿堿液裂解細胞提取高溶化性蛋白;把未溶化的用標準液溶化提取高疏水性蛋白;最后用含復合表面活性劑的蛋白溶化液,最后可以再度抽提前兩次抽提后不能溶化的膜蛋白。
5)
原理:高滲的蛋白裂解液讓細胞溶漲斷裂后,超高速離心
評價:雖然分級(胞漿和胞膜)之間有清洗的步驟,并且可溶性蛋白組分和膜蛋白組分之間依然有不少重復的點.該方式相較MP院士在1998年上發表的分級抽提法除以了第一步(用tris抽提水溶性蛋白)和最后一步(極難溶蛋白),在操作上也作了簡化,總而言之是一種不錯的方式。()
6)-based:提取時先裂解液裂胞膜(選用不同的去污試劑是關鍵),梯度離心分離細胞器(ER),之后分級抽提方式。諸如,除去細胞器以后的就是核膜,再裂解得到核膜蛋白。而膜蛋白是裂胞膜時不溶的部份。
總的體會:細胞的量要很充足。以后的定性鑒別常用的技巧有單向免疫擴散、免疫電泳及聚丙稀丙酯凝膠電泳等。純化蛋白質含量的定量測定可用雙縮脲法、酚試劑法或紫外光吸收法定量鑒別膜蛋白,便捷迅速。
到目前為止,提取膜蛋白一直是蛋白學的一個困局。
2、分離膜蛋白的方式(操作)
1)分離細胞膜蛋白的方式:
1、冰上刮下細胞后將細胞溶于有蛋白酶抑制劑的緩沖液A中,于溫度與液氮罐中反復凍融2次。
2、5000轉4度離心,清除核及未裂解的細胞。
3、取上清12000轉4度離心10分鐘取沉淀溶于有蛋白酶抑制劑的緩沖液B中。
4、12000轉4度離心10分鐘取沉淀溶于有蛋白酶抑制劑的緩沖液C中提取后測蛋白含量,SDS-PAGE電泳,分裝后-20度保存備用。
A:,,3mMMgcl2,50mMHepes,1mMDTT,0.5ug/ml,20uMpmsf(PH=7.4)
B:,,3mMMgcl2,50mMHepes,1mMDTT,0.5ug/ml,20uMpmsf(PH=7.4)1mMEGTA
C:0.5ug/ml,20uMpmsf,-cl(PH=7.0),
2)分離細胞膜蛋白的方式:
1、細胞置于冰上,除去上清,用pH7。4的冷乙酸鹽緩沖液漂洗雙層細胞兩次
2、加入1ml2%堿液冰浴15min
3、刮下單層細胞,4度下10000g5min離心
4、溶液37度水浴10min以分離水相和去污劑相,之后37度下2000g離心5min
5、收集水相留作剖析
6、用500ul冰涼的C溶化去污劑相沉淀,冰浴2min后加溫,在按步驟6再度離心
7、按步驟8再度抽提去污劑相,用C將漂洗后的去污劑相稀釋到初始容積
8、用等量的A分別稀釋水相與去污相,并進行免疫沉淀實驗
試劑:
1、2%:2%、/LTrisHCl(pH7。5)、蛋白酶抑制劑
2、緩沖液A(含0。5mol/LNaCl的RIPA)
3、C
/LTrisHCl(pH7.5)
/LNaCl
5mmol/LEDTA(PH7.5)
3)分離細胞膜蛋白的方式:
7Murea
2M
4%chaps
2.5%sb3-10
個細胞,可用此1ml。冰浴勻漿。冰上置30分鐘。
4度高速高溫離心30min。
取上清-20保存。
4)分離組織膜蛋白的方式:
1、取組織,加入10mlA于冰上充分勻漿。
2、J6-HC離心機,4℃離心10min后,所得堿液轉到超速離心管。
3、,4℃離心1hr。棄去上清,沉淀用適量的B重懸,冰上孵育2hr后分裝至EP管,臺式離心機,4℃離心30min。
4、收集所得堿液即為膜組份。
A:0.32M蔗糖,5mMTris-HCl(PH7.5),120mMKCl,1mMEDTA,1mMEDTA,0.2mMPMSF,1ug/ml,1ug/mlA,1ug/ml。冰上預冷。
B:20mMHEPES(PH7.5),10%甘油,2%X-100,1mMEDTA,1mMEDTA,0.2mMPMSF,1ug/ml,1ug/mlA,1ug/ml。冰上預冷。
5)分離組織膜蛋白的方式:
RIPA
1XPBS
1%NP40
0.5去氧膽酸鈉
0.1%SDS
以下用時加入
10mg/mlPMSF異戊烷(終含量10ul/ml)
(30ul/ml)
(10ul/ml)
冰凍組織100mg/細胞個,可用RIPA1ml。冰浴勻漿。冰上置30分鐘。
4度高速離心30min,20000轉高溫離心最佳。
取上清-20保存。
6)分離真菌膜蛋白的方式:
1、于20ml營養魚湯中過夜培養真菌,37℃,。
2、、20min、4℃離心,去上清。
3、20ml預冷的Tris-Mg緩沖液重懸,同樣條件離心細胞膜色譜,再重懸于預冷的Tris-Mg緩沖液。
④超聲波破碎真菌。
⑤3000g,10min、室溫下離心除去未破碎真菌。當心汲取上清(富含胞質成份和真菌外被成份)。
⑥超速離心I:100,000g,60min,4℃,除去上清(胞質成份),搜集病菌外被成份。
⑦用10ml含2%的SLS的Tris-Mg緩沖液重懸沉淀物,溫度溫育20-30min。
⑧超速離心II:70,000g,60min,溫度沉淀搜集外膜蛋白,除去上清(含細胞質膜)。重復⑦、⑧兩步。
⑨充分吸除上清,并按照沉淀容積大小用0.1-0.2ml的ddH2O重懸沉淀物。依據公式:蛋白含量(mg/ml)=1.450D280-0.740D260測定外膜蛋白含量,調節蛋白含量至40ug/ul,該蛋白質樣品-70℃貯存。
試劑
①Tris-Mg緩沖液
10mMTris-Cl
5mMMgCl2
pH7.3,4℃保存
②2%(w/v)十二羰基肌氨酸鈉(SLS)
7)來始于(1974)
1、取一定量酶處理的細胞,用勻漿器破碎,操作要溫和,使細胞膜保持完整。因為水與膜的疏水部份之間有反應,因而要精確把握分離介質中的離心硬度和滲透壓,以每克細胞濕重加40ml介質。
2、用-勻漿器,桿與壁間間隙0.5~0.6μm,14.4kr/min上下勻漿4~6次,每次5S。
3、過濾勻漿液,150g離心10min,保留上清,沉淀部份加入50μl介質,用勻漿器1kr/min勻漿3次,150g離心10min,沉淀部份再加入先前勻漿的堿液。
4、合并3次堿液細胞膜色譜,2kg離心10min,棄上清,沉淀部份溶于100μl介質,離心10min,棄上清,留沉淀。
5、將沉淀部份加入70%蔗糖15份,之后分別放在三個離心管中,前面依次疊加54%、49%、45%,41%,37%蔗糖堿液各2、2、5、5、3份。
6、700kg離心90min,分離介質在1.16~1.18之間產生介面。
7、收集d為1.16~1.18g/ml之間的細胞膜,加30倍的介質以2.5kg離心10min,漂洗2次。
8、保存于2.7mmol/LTris-HClpH7.5緩沖液中,用于細胞膜的研究剖析
8)常用的制備粗制質膜組分的方式:(所有操作都在4攝氏度下進行)
1.在冰涼的勻漿緩沖液中搗碎組織塊,倒流血水。用勻漿緩沖液洗滌組織尸塊,并將它們放在冰上,重復上述操作,直到組織碎成1mm3大小的碎片,且無可見的血。
2.加入5倍(容積比)與組織塊容積的緩沖液,再放在冰浴的氏玻璃勻漿器中,抽研10-20次,勻漿組織。
3.勻漿4攝氏度600g離心10min,上清含細胞膜、線粒體和細胞溶膠。沉淀中有未破碎的細胞及細胞核。棄沉淀。
4.上清4攝氏度8000g離心10min,沉淀線粒體。棄沉淀。
5.上清4攝氏度離心20min,棄上清。
6.用勻漿緩沖液重懸沉淀,繼續勻漿,再度4攝氏度,離心20min,棄上清。
7.用小容積的適合緩沖液重新徹底勻漿沉淀。
8.粗制的樣品可于干冰/乙酸中速凍,保存于-80攝氏度。
9)用特殊的去污劑選擇性的分離。
簡單,可靠,但有時富含其他蛋白。
原理:4度時所有的蛋白質原則上都溶于水堿液,但在37度時,此堿液分為水相和去污相;此時親水性蛋白溶于水相,疏水的膜蛋白溶于去污劑相中。
方案
1、放射性標記受試細胞
2、將標記的細胞置于冰上
3、去除上清,用pH7。4的冷乙酸鹽緩沖液漂洗雙層細胞兩次
4、加入1ml2%堿液冰浴15min
5、刮下單層細胞,4度下10000g5min離心
6、溶液37度水浴10min以分離水相和去污劑相,之后37度下2000g離心5min
7、收集水相留作剖析
8、用500ul冰涼的C溶化去污劑相沉淀,冰浴2min后加溫,在按步驟6再度離心
9、按步驟8再度抽提去污劑相,用C將漂洗后的去污劑相稀釋到初始容積
10、用等量的A分別稀釋水相與去污相,并進行免疫沉淀實驗
試劑:
1)2%:2%、/LTrisHCl(pH7。5)、蛋白酶抑制劑
2)緩沖液A(含0。5mol/LNaCl的RIPA)
3)C
/LTrisHCl(pH7.5)
/LNaCl
5mmol/LEDTA(PH7.5)
10)動物中:高度純化的質膜是質膜蛋白研究的基礎,制備純化方式也好多,動物材料中以
1、蔗糖密度梯度離心、
2、水溶性雙水相法、
3、自由流電泳等方式為主。
