

新聞·提要
日前,重慶交通學(xué)院醫(yī)大學(xué)附屬仁濟(jì)附院放射科周滟團(tuán)隊在(影響因子IF:15.1)上報導(dǎo)了巨噬細(xì)胞分泌外囊泡修飾鈀納米劑型(Pd@M)在調(diào)節(jié)壞疽性結(jié)腸癌(UC)大鼠肝臟發(fā)炎和免疫微環(huán)境穩(wěn)態(tài)方面發(fā)揮關(guān)鍵作用并剖析背后機(jī)制。該工作有助于進(jìn)一步思索靶點(diǎn)納米抗生素用于干預(yù)免疫穩(wěn)態(tài)的相關(guān)靶向,為醫(yī)治壞疽性結(jié)腸癌病人提供了一種具有前景的取代選擇。

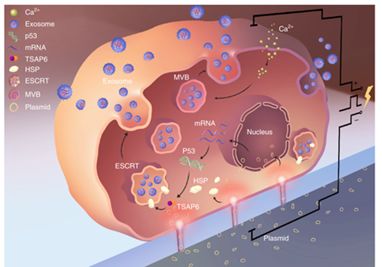
壞疽性結(jié)腸癌(,以下簡稱UC)是一種慢性發(fā)炎性腸病,常表現(xiàn)為結(jié)結(jié)腸發(fā)炎并發(fā)淺表糜爛性胃炎,易惡變,以血性水腫、腹部疼痛和發(fā)熱為特點(diǎn)。目前的抗生素醫(yī)治惡變率高且不良反應(yīng)多,醫(yī)治療效不甚滿意。在生物醫(yī)學(xué)領(lǐng)域,納米材料可以克服天然抗氧化劑的半衰期短、多次給藥會降低毒副作用、吸收率和生物借助率低等缺點(diǎn)。其中,貴金屬納米粒子因其高穩(wěn)定性和可調(diào)催化特點(diǎn)而飽受關(guān)注,鈀(Pd)具有類SOD和CAT酶活性,可有效消除ROS。為了增強(qiáng)納米抗生素的靶點(diǎn)性,基于細(xì)胞膜的納米療法已發(fā)展成為推動醫(yī)治劑靶點(diǎn)遞送的有效方式,由于它將納米材料的功能多樣性與細(xì)胞膜的生物仿生受體和傳感相結(jié)合。在確保最佳生物相容性和靶點(diǎn)能力的前提下細(xì)胞膜穩(wěn)態(tài)劑,巨噬細(xì)胞衍生的細(xì)胞外囊泡已成為巨噬細(xì)胞膜的可靠代替品,可用于開發(fā)靶點(diǎn)發(fā)炎區(qū)域的生物仿生給藥系統(tǒng)。本研究針對UC的免疫微環(huán)境衰弱,借助巨噬細(xì)胞來源外囊泡修飾Pd的策略來解決了抗生素靶點(diǎn)性低的問題,因而特異性改善大鼠壞疽性結(jié)腸癌損傷。
UC的發(fā)生與腸上皮屏障缺陷、微生態(tài)失調(diào)和免疫反應(yīng)失調(diào)密切相關(guān)。巨噬細(xì)胞在先天性和適應(yīng)性免疫反應(yīng)中發(fā)揮關(guān)鍵作用。糖酵解介導(dǎo)的M1巨噬細(xì)胞極化分泌促炎細(xì)胞因子,加重發(fā)炎反應(yīng);而M2巨噬細(xì)胞分泌祛痰細(xì)胞因子,參與組織的發(fā)炎和損傷修補(bǔ)。在UC的病理?xiàng)l件下,mTOR1和HIF-1α是巨噬細(xì)胞獼猴桃糖代謝轉(zhuǎn)換的核心調(diào)節(jié)因子,可被過量ROS觸發(fā)。前期相關(guān)研究局限于關(guān)注Pd消除ROS的表現(xiàn),但對于Pd@M在此基礎(chǔ)上怎么進(jìn)一步調(diào)節(jié)UC相關(guān)的免疫和發(fā)炎反應(yīng)仍知之極少。
在這項(xiàng)研究中,周滟團(tuán)隊闡明了Pd@M可能通過調(diào)節(jié)-HIF-1α介導(dǎo)的糖酵解通路抑制M1巨噬細(xì)胞極化,降低中性粒細(xì)胞的募集和浸潤,因而塑造肝臟發(fā)炎和免疫微環(huán)境。該團(tuán)隊在細(xì)胞和植物層面上證明了Pd@M可以降低發(fā)炎狀態(tài)下的ROS水平和細(xì)胞死亡,正向調(diào)控免疫細(xì)胞狀態(tài)和腸黏膜屏障功能。最終,通過小昆蟲MR等表征手段,Pd@M顯著減緩了壞疽性結(jié)腸癌大鼠的臨床病癥和影像學(xué)征象。鑒于以上發(fā)覺,同時考慮到所用Pd結(jié)構(gòu)可以通過一步法合成并具有極好的穩(wěn)定性,Pd@M有望用于通過維持胃腸免疫穩(wěn)態(tài)來靶點(diǎn)醫(yī)治大鼠結(jié)腸癌。
(圖:Pd@M的合成、靶向能力和醫(yī)治策略)
仁濟(jì)診所放射科碩士研究生程嘉慧、張一銘和清華學(xué)院附屬兒科診所放射科馬亮醫(yī)師為該論文第一作者細(xì)胞膜穩(wěn)態(tài)劑,仁濟(jì)診所放射科組長醫(yī)師周滟、住院醫(yī)師李博和重慶交通學(xué)院農(nóng)業(yè)與生物大學(xué)厲曉楊博士為共同通信作者。該工作得到國家自然科學(xué)基金委、上海市衛(wèi)生健康領(lǐng)軍人才、市教委探求者項(xiàng)目等支持。
論文鏈接: