S=klnW,式中,S代表熵,k為玻爾茲曼常數,W為微觀態數,有的化學家將W稱為相空間的體積。 不知道有多少男同伴被這個公式震驚了,別擔心,我們用一個簡單的方式來理解熵這個數學量的含義。
啟迪我們的小腎,玩個游戲:
蒙住眼睛,隨機將蘋果、香蕉、梨放入兩個袋子中,然后你就可以猜。 每個奇異果可以有兩個行蹤。 因此,3根香蕉一一放入,即2×2×2=2^3=8,即總共可以有8種組合,所以我們猜到答案的概率是1/ 8。
現在我們用數學的語言來談談這個猜香蕉游戲。 8種可能性對應8種微觀狀態。 這個8就是公式中的W。 這個游戲中熵的值與8的對數成反比,你猜對了,概率是1/8。
升級版游戲:思想實驗
取一個六面體容器,里面裝滿了 10^10 個相同的二氧化碳分子。 現在我們將使用一個架子將這個簡易裝置分成相等體積的左右部分。 這個二氧化碳分子就相當于游戲中的果汁物理是什么科學,架子隔開的兩部分就相當于兩個袋子。
從統計學上來說,二氧化碳分子不可能全部集中在容器的一側,而一側處于真空狀態,因為這種情況發生的機會實在是太小了。 從數學上講,如果發生這種情況,容器一側條紋上方的空氣溫度將低于一側條紋上的體溫。
我們可以估計右邊袋子里n個分子的微觀狀態。 我們可以先從10^10中選擇n個分子的組合數。 這個數字的對數意味著有n個二氧化碳分子位于右側條帶中的可能性大小。
這個分布對應的熵的大小是可以估計的,它的值可以作為判斷某事是否還能發生的依據。 在我們的思想實驗中,熵的值是在n=5×10^9時取的。
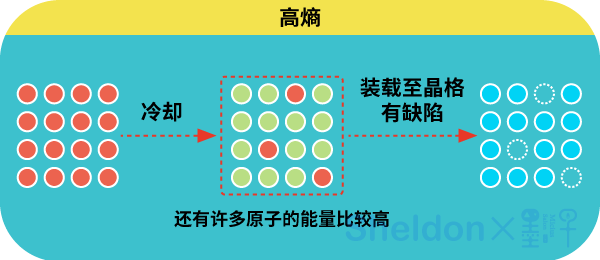
從這個思想實驗中,我們還可以看出,熵的值代表了一個系統存在的可能性,它與系統微觀狀態數的對數成反比。 換句話說,熵代表了系統的無序程度,微觀狀態數量越多,混亂程度越高,熵就越大。
公式S=klnW是如何得出的?
最初,熵這個數學量是在熱力學第二定理提出時引入的。 根據微分關系,可以將熵的值確定為任意常數,但該常數無法從熱力學第一定理和第二定理中獲得。 由此可見,為了確定熵的絕對值,需要用到熱力學第三定律。
熱力學第三定理與研究熱機工作原理時發現的第一定理和第二定理不同。 該定理是能斯特在研究各種物質在極低溫度下的物理反應性質時發現的,所以又稱為能斯特定理。
其內容是:等溫過程中聚集體的熵隨著溫度趨于絕對零而趨于零。 也可以描述為絕對零不能達到的原理,即不可能用有限的步驟將物體冷卻到絕對零。 用物理學來表達就是右圖的極限表達式。
根據熱力學第三定律,熵的公式可以寫成右圖中的多項式
由于熵常數S0是絕對常數,與狀態無關,1911年,普朗克進一步發展了能斯特定理,選擇熵常數為零,并將熵公式變成了圖中的多項式正確的。
這樣,熵的值就完全確定了,并且不包含任何常數,所以稱為絕對熵。 熵函數的定值只需要一個潛熱數據,那么為什么要用物態多項式,而是在積分時保持x不變。 在絕對零時,任何物體的熵都變為零(當溫度趨于零時,其他個體條件必須保持不變,如體積恒定等)是量子統計的推論。
如果系統在絕對零處有一系列基態E0、E1、E2…、En,則系統一定處于能量最低的量子態——基態,并且此時只有一個微觀態時間。
根據量子統計學,玻爾茲曼得到了這樣的關系:S=KlnW,其中W是微觀態的數量,則S=Kln1=0。 W=1意味著能級是非簡并的。 有很多系統滿足這個條件物理是什么科學,如晶格結構、量子二氧化碳等,但并不要求W=1。 雖然W>>1,但仍然滿足量子統計的要求。 熱力學極限。
結論
通過前面的分析,我們可以得到這樣的推論。 熵是化學家定義的數學量。 該化學量與系統中微觀狀態的對數或某種系統狀態出現的概率成反比。 不知道看完這篇文章,你是否對數學量熵的數學意義有了一定的了解呢?
歡迎關注@郭哥談科學,專攻數學的科普作者,為科學發聲,為愛好者答疑解惑,持續輸出優質科普文章。
如果你想了解更多化學知識,歡迎訂閱我的最新專欄《物理技巧》,訂閱前別忘了發放10%的折扣優惠券。
