


隨著對生物大分子結構的逐步分析,研究人員對細胞生理學的認識也在不斷創新。
哈佛大學吳浩教授的實驗室專注于參與免疫信號通路的分子的結構生物學,這些信號通路使細胞能夠抵抗感染和破壞性刺激。 2015年當選為美國科學院院士。這些工作首次解析了信號體()的結構并定義了超分子組裝中心(SMOCs)[1],填補了經典細胞器研究的空白。以及在壓力后短暫組裝的分子復合物。 吳浩教授的主要工作解釋了炎癥通路中SMOCs——如炎癥小體()等——如何組裝和發揮作用,為靶向藥物治療提供了重要參考。
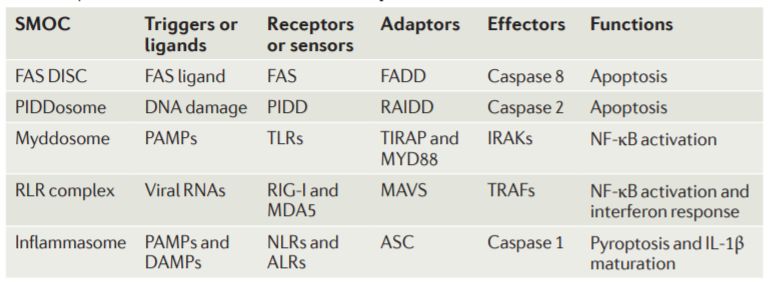
SMOC 在先天免疫中的作用,引用于:Nat Rev 14:821–826
北京序幕
吳浩教授出生于北京,父母都是物理學家。 高中時他對生物學產生了濃厚的興趣,高考后他選擇進入北京協和醫學院學習臨床醫學。 在北京大學醫學預科學習期間,吳浩教授對攝影產生了濃厚的興趣,這似乎拉開了未來X射線晶體學研究的序幕。
在協和醫學院期間,吳浩教授參與了系統性紅斑狼瘡的研究。 這項工作促使她考慮離開醫學院并攻讀研究學位。 1987年在北京舉行的國際生物化學會議上,吳浩教授結識了普渡大學結構生物學教授,并對他的研究產生了興趣(該教授是X射線晶體學的先驅,幫助麥克斯分析了血紅蛋白的結構,這一發現幫助后者獲得了1962年諾貝爾化學獎)。 X射線晶體學需要復雜的數學和物理方法來解決生物學問題,這也正是吸引吳浩教授的地方。

吳浩教授、教授。 圖片引用自:
隨后,吳浩教授前往普渡大學,在教授的指導下開始研究晶體學和病毒學。 此時晶體學的自動化技術手段還很少,計算機能做的事情也比較有限。 吳浩教授也自學了語言,開始尋找自己解決結構問題的方法。
CD4結構
1992年,吳浩教授獲得博士學位,并加入哥倫比亞大學韋恩實驗室擔任博士后研究員。 此時,艾滋病危機開始在全球蔓延,吳浩獲得資助開始分析T細胞受體CD4分子的結構。 在最終的結構模型中,吳浩教授發現CD4分子在T細胞傳感信號中形成二聚體,并形成更大的分子簇[2]。 吳浩教授在回顧這項研究時表示,這也是他第一次接觸寡聚蛋白研究,隨后寡聚蛋白成為他研究的核心主題。
“在接下來的十年中,我們發現細胞內信號蛋白可以組裝成更大的寡聚蛋白復合物,而我們往往將其視為錯誤聚集或錯誤折疊的蛋白質。”
先天免疫研究
1997年,吳浩教授接受康奈爾大學終身教職。 此時,吳浩教授開始關注腫瘤壞死因子(Tumor,TNF)通路,這也開啟了吳浩教授天然免疫研究的開端。
當時的主流觀點是,細胞能否存活僅取決于TNF是否對刺激和應激做出反應,但吳浩教授的工作發現,這條通路仍然可以有不同的分支。 該部分工作分析了TRAF2(TNF-2)和TRADD(TNF type 1-death)的結構,有助于闡明TRAF2如何通過調節TRADD來實現對細胞凋亡啟動的“制動”作用[3, 4]。
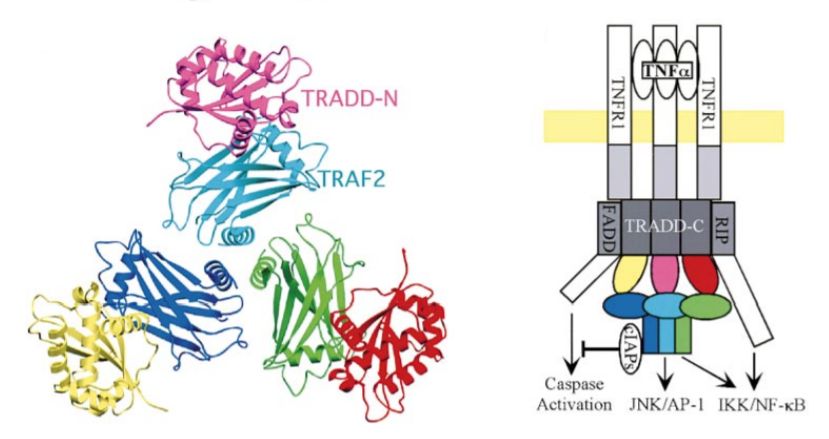
TNFR-TRAF2-TRADD的結構示意圖,引用自:Cell 101:777–787
吳浩教授團隊隨后繼續分析其他含有死亡的蛋白:RAIDD(RIP-帶有死亡)和PIDD(p53-帶有死亡)[5]。 在該模型中,7個RAIDD和5個PIDD與-2結合形成不對稱多蛋白寡聚體復合物-。 幾年后,吳浩團隊再次分析了Toll樣受體信號通路中涉及的成分[6],發現該復合物具有螺旋對稱結構,類似于雙螺旋。 這種開放的結構使其能夠輕松地繼續組裝和組合新的子單元。
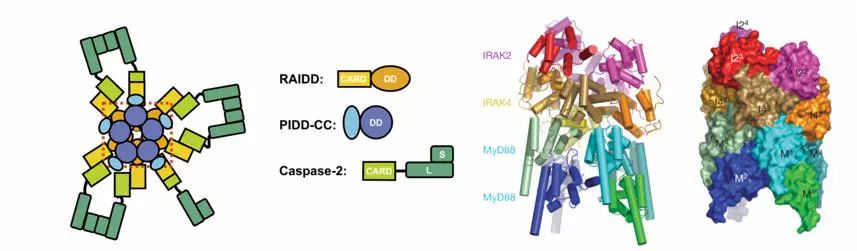
不對稱結構和對稱結構(引用于《細胞》128:533–546;465:885–890)
技術創新
隨著工作逐漸轉向大分子復合物,吳浩團隊開始整合冷凍電鏡技術進行結構分析。 結合這些技術,吳浩教授團隊分析了參與炎癥細胞死亡或壞死性凋亡的壞死體()的結構。 這是一種不同于細胞凋亡的程序性細胞死亡。 壞死體的結構生物學有助于更好地理解這種類型的細胞死亡。 在后續工作中物理學家做哈佛教授,吳浩教授發現壞死體也具有β-淀粉樣蛋白(β-)結構[7],并且冷凍電鏡的應用將這種纖維狀結構細化到接近原子精度[8] ]。
吳浩教授對SMOCs的研究表明,無論是壞死體、炎性小體,還是其他信號體,其結構都是由多種免疫蛋白相互作用、結合形成功能復合物組成。
信號體-
隨著研究的進展,吳浩教授對細胞內蛋白質相互作用有了新的認識和隱喻。 她認為,細胞就像一個文明社會,有村莊和城市,大多數反應都發生在其中。 細胞內形成的對稱多價組合使分子在這些地方聚集,局部完成生化反應,進而改變細胞的生理狀態。 吳浩教授認為,這種高層結構具有革命性的優勢。 多價相互作用使復合體的成員能夠正常合作并完成組裝。 因此,在不需要誘導細胞凋亡、壞死性凋亡和焦亡時,不要反應過度。
靶向治療
2012年,吳浩教授在康奈爾大學完成近20年的研究后,轉至哈佛大學波士頓兒童醫院繼續研究。 此時,吳浩教授開始拓展自己在免疫學方面的研究,包括介導抗體多樣性的功能蛋白的結構生物學研究[9],以及炎癥小體等信號體在信號轉導和放大中的作用。 作用[10],以及焦亡后細胞死亡的下游事件[11]。
在最新的研究論文中[12],吳浩教授開始將自己的工作推向新的方向,試圖幫助腫瘤、自身免疫性疾病等疾病的臨床治療。 吳浩教授希望他在結構生物學方面的工作能夠幫助尋找新的治療靶點。

圖為2018年中國生物學家協會主席吳浩教授(左三)在中國生物學家協會第十二屆學術會議晚宴上與其他與會專家合影。 鐘為民教授(左二)、陳平教授(左四)、南方科技大學校長陳十一教授(左五)、現任中國生物學家協會主席康宜斌教授(右四)、王小凡教授(右二),李國家教授(右一)。 圖像:

參考
1.Kagan JC、VG、Wu H. SMOCs:即。 2014;14(12):821-6。
2. Wu H,Kwong PD,華盛頓州。 以及人類CD4的。 1997;387(6632):527-30。
3.Park YC,V,Villa AR,Tong L,Wu H.自我和人類TRAF2的基礎。 1999;398(6727):533-8。
4.Park YC,Ye H,Hsia C,Segal D,Rich RL物理學家做哈佛教授,Liou HC,等。 TRADD-TRAF2 的 TRAF 小說。 細胞2000;101(7):777-87。
5. Park HH、E、S、S、Walz T、J 等人。 核心之死。 細胞2007;128(3):533-46。
6.Lin SC、Lo YC、Wu H.在TLR/IL-1R中的MyD88-IRAK4-IRAK2。 2010;465(7300):885-90。
7. 李杰,T,AB,J,K,蕭YS,等。 RIP1/RIP3 形成一個 for . 細胞2012;150(2):339-50。
8.盧A,VG,阮J,尹Q,MK,Vos MR,等。 對于 ASC- 。 細胞2014;156(6):1193-206。
9.來自RAG1-RAG2的V(D)J的Ru H,MG,Fu TM,Tong AB,Liao M,Wu H.。 細胞2015;163(5):1138-52。
10. 張麗,陳松,阮靜,吳靜,佟AB,尹清,等。 NAIP2-NLRC4 的冷凍電鏡。 2015;350(6259):404-9。
11.阮杰,夏松,劉新,J,吳紅。A3孔的冷凍電鏡。 2018;557(7703):62-67。
12.Li Y,Fu TM,Lu A,Witt K,Ruan J,Shen C,等。 ASC 和 NLRC4 CARD a 和 -1 的冷凍電鏡。 2018 年的 ;115(43) :10845-52。
制版師:資陽