

11月14日,中國科大學北京免疫與感染研究所研究員劉星,聯合國外耶魯學院院長Judy、同濟學院院長張鵬團隊,在《免疫》()上,發表了題為Dofinnerandouterand的封面文章。該研究首次闡明并報導了GSDMD介導線粒體損傷的分子機制,并進一步闡述了其在細胞焦亡訊號放大及提高機體抗感染/抗肺癌免疫應答過程中的關鍵作用。
細胞焦亡()是依賴蛋白家族質膜打孔引起的新型細胞炎性程序性死亡,是機體免疫系統對抗外源病原菌入侵的主要手段之一,亦是近幾年癌癥免疫醫治領域的新熱點。線粒體是細胞死亡、分化、增殖及免疫反應的中心樞紐。既往研究報導GSDMD/E介導的細胞焦亡初期伴隨線粒體損傷發生,但其具體分子機理和作用機制仍未可知。
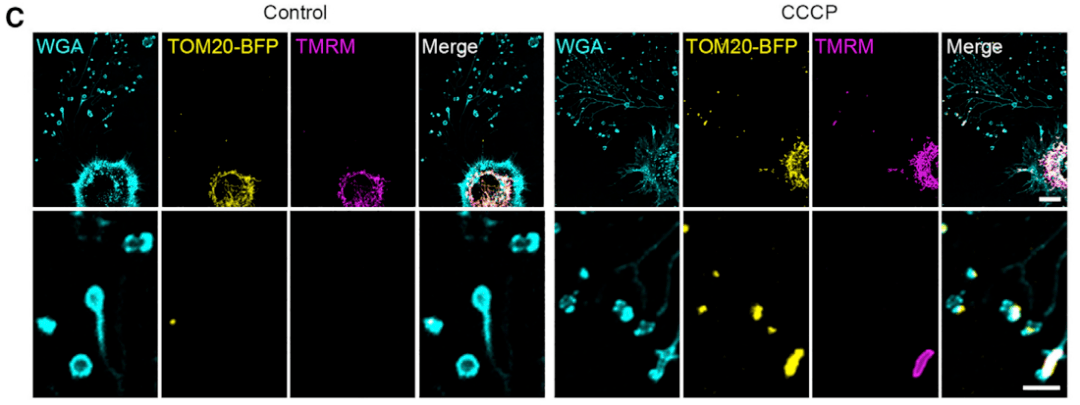
為探究線粒體在細胞焦亡中的作用細胞膜損傷,研究人員用脂寡糖(LPS)+印尼菌素()處理單核巨噬細胞發覺,在焦亡發生初期,線粒感受發生去極化,同時,活化的GSDMD-NT會轉位至線粒體并在其膜上成孔,致使線粒體膜通透;進一步通過中單粒體膜電位變化、ROS形成及細胞死亡統計剖析發覺細胞膜損傷,GSDMD造成的線粒體功能障礙發生于細胞死亡之前,且線粒體缺陷會明顯增加細胞焦亡誘導。對于相死機制的進一步研究表明:細胞焦亡初期,GSDMD-NT會首先轉位至線粒體,且在細胞膜成孔之前,導致線粒體損傷;該過程依賴心磷脂從線粒體內膜(IMM)翻轉至外膜(OMM),且不依賴介導細胞自噬的BAX、BAK蛋白和線粒體私密性轉換孔等。體外實驗闡明:GSDMD-NT可直接損傷線粒體,且GSDMD介導的線粒體損傷誘導3’端-5’端的核苷酸外切酶PNPT1釋放入胞質,引起廣泛的mRNA降解以加重細胞焦亡發生、放大下游炎性反應。據悉,該研究還闡明了線粒體損傷提高細胞焦亡誘導的機體抗肺癌免疫應答。
綜上,該研究首次闡明了細胞焦亡初期GSDMD誘導線粒體損傷的關鍵分子機制及其在細胞焦亡過程中的關鍵“不可逆轉性”與“信號放大”功能。該研究闡明了一種新型由成孔蛋白介導的線粒體細胞死亡通路,為病衣原體感染及癌癥等相關病癥的防治/醫治提供了新的思路與靶向。
論文鏈接:(23)00444-2
▲細胞焦亡發生初期,GSDMD-NT介導線粒體損傷并放大下游增生反應及細胞焦亡。