壓力和容積的關系式是克拉伯龍多項式:PV=(m/m)RT。
P是二氧化碳的浮力,單位為帕。
V是二氧化碳的容積。
m是二氧化碳的質量。
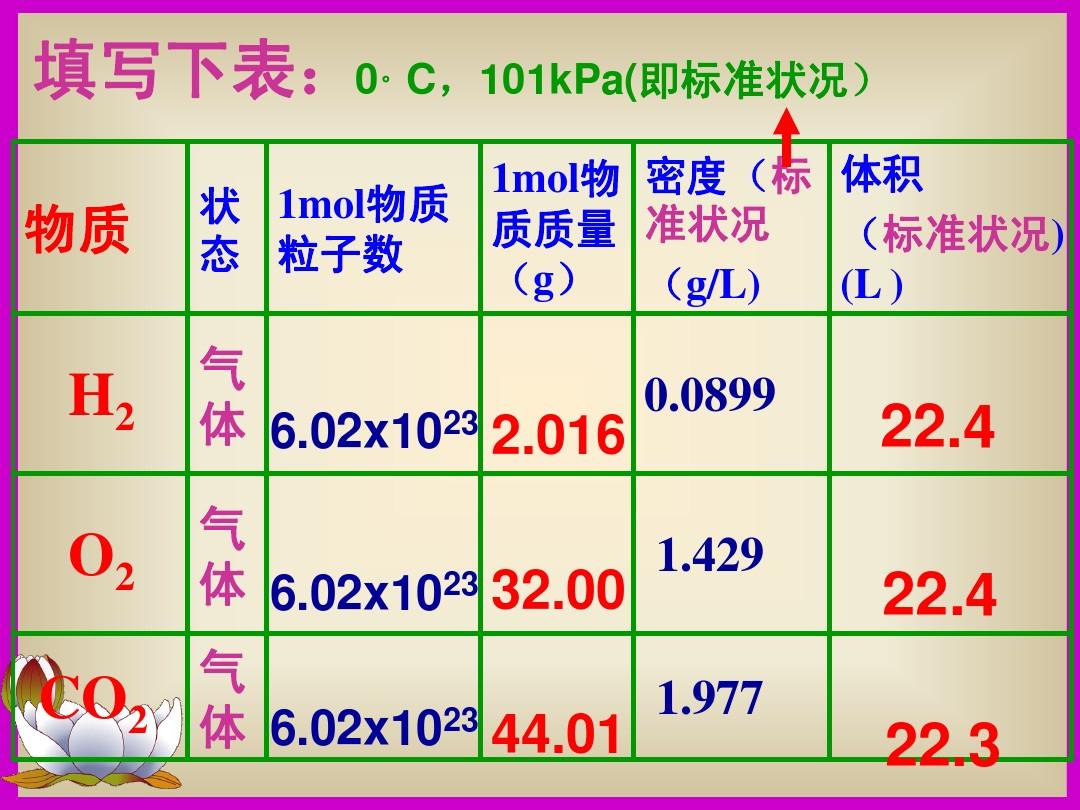
M是二氧化碳的摩爾質量,(m/M)為摩爾數。
R是二氧化碳普適恒量,R=8.31J/mol。
T是二氧化碳的濕度,單位為開爾文。
詳盡知識講解請看下方具體內容:
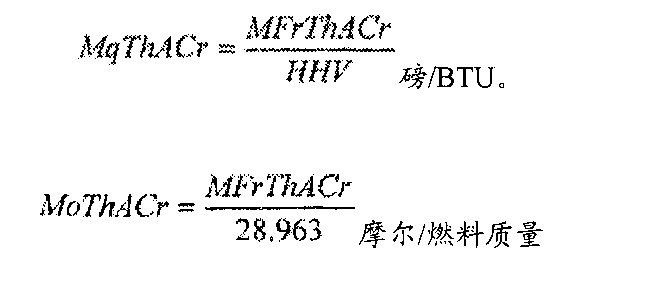
1、克拉伯龍等式描述的是單物質在一階相變相平衡時侯化學量的變化多項式。即定量剖析單物質在摩爾數一樣時物質容積(V)、溫度(T)、壓強(P)的關系。
2、pV=nRT是克拉伯龍多項式。p為二氧化碳浮力壓強計算公式及單位,單位Pa。V為二氧化碳容積,單位m3。n為二氧化碳的物質的量,單位mol,T為體系體溫,單位K。R為比列系數,數值不一樣狀況下帶來一定不一樣,單位是J/(mol·K)。
3、在摩爾表示的狀態多項式中,R為比列常數,對任意理想二氧化碳來說,R是一定的,約為8.31441±0./(mol·K)。
4、理想二氧化碳狀態多項式,描述理想二氧化碳狀態變化規律的等式。由克拉伯農于將玻意耳定理和蓋-呂薩克定理合并上去。雖然理想二氧化碳狀態等式是由克拉伯農提出的,而且,克拉伯農多項式所描述的是相平衡的化學量。國際慣例,將理想二氧化碳狀態多項式稱為StateofIdealGas或則IdealGaslaw,而克拉伯農多項式的同義詞是-或則。
壓力和容積的公式是克拉伯龍多項式:PV=(m/M)RT。P是二氧化碳的浮力,單位是帕斯卡。V是二氧化碳容積。m是二氧化碳質量。M是二氧化碳lm摩爾質量。(m/M)為摩爾數。R是二氧化碳普適恒量,R=8.31J/mOl。T是二氧化碳的氣溫壓強計算公式及單位,單位是開爾文。浮力和容積的乘積是物體壓縮二氧化碳所做的功。由于浮力定義是物體單位面積上所受遭到的壓力。浮力的估算公式為P=F/S,當壓縮二氧化碳聯通距離h時,被壓縮容積為V=Sh,甚或,這個時侯浮力乘于容積等于pXV=F/sXSh=Fxh,由功的估算公式W=Fxs就可以清楚的曉得應為壓力所做的功。
