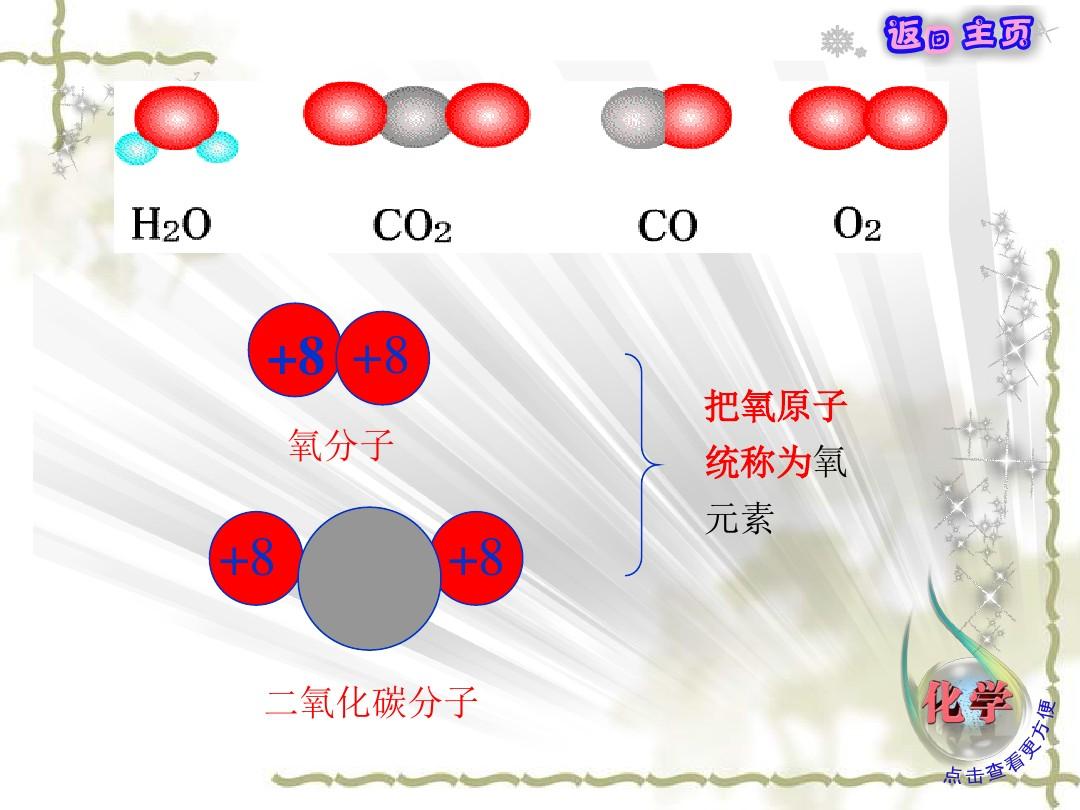
本節將在此基礎上,通過與實驗檢測值的比較,得到能量均分定律,處于平衡態的理想二氧化碳每位分子的平均平動動能為從理想二氧化碳熱運動無擇優取向知kT由第一章曉得這說明在理想二氧化碳中,x、y、z三個方向的平均平動動能都均分kT一、自由度與自由度數分子的熱運動除平動外,還有轉動和分子內原子間的震動。雙原子分子、多原子分子及單原子分子之間的差異。單原子、雙原子、多原子理想二氧化碳潛熱的差別,在于它們的分子結構各不相同,必需引用熱學中自由度這一概念。自由度的定義:描述一個物體在空間的位置所需的獨立坐描述一個物體在空間的位置所需的獨立座標稱為該物體的自由度標稱為該物體的自由度。。決定一個物體在空間的位置所需的獨立坐決定一個物體在空間的位置所需的獨立座標數稱為自由度數標數稱為自由度數。你們曉得,確定一個質點的空間位置需三個獨立座標,故自由度數是3個。一個質心作定點轉動時的轉動自由度數為一個剛性多原子分子既在空間平動又作轉動,確定空間位置就需六個獨立座標,它的自由度數是六個。雙原子分子本身很像一個杠鈴,每位原子的質量都集中在直徑為10-1510-10其直徑之比為10-1510-1010-5由于轉動力矩與回轉直徑平方成反比,,所以轉動力矩之比為10-10倍。
轉動角速率相同時的轉動能量之比也是10-10倍。故雙原子分子繞中心軸轉動自由度毋須考慮,剛性雙原子分子的自由度數為三個平動自由度兩個轉動自由度。非剛性雙原子分子有一個沿兩剛體聯線震動的震動自由度,其自由度總量為六個。分子中的所有原子都在一條聯心線上的分子稱為稱為線型分子,它的轉動自由度也只有兩個。單原子分子只有三個平動自由度雙原子分子的自由度數最多可以有6個。由此可恐怕到由此可恐怕到,,NN個原子組成的多原子分個原子組成的多原子分子子,,其自由度數最多為其自由度數最多為33NN個個。。在這在這33NN自由度中自由度中,,有三個有三個((整體整體))平動平動、、三個三個((整體整體))轉動及轉動及個震動自由度個震動自由度。。二、能量均分定律每一自由度均分到kT平均動能。若將這一規律推廣到轉動和震動自由度中,覺得每一轉動及震動自由度也均分kT再考慮到剛性分子無震動自由度這一點,對照表2.2中的一些數據,kT能量均分定律是指每位分子的每一個自由度均分kT平均動能。能量均分定律(玻爾茲曼假定)——處于室溫處于室溫的平衡態的二氧化碳中,分子熱運動平均動能的平衡態的二氧化碳中,分子熱運動平均動能平均分配到每一個分子的每一個自由度上,平均分配到每一個分子的每一個自由度上,每一個分子的每一個自由度的平均動能都是每一個分子的每一個自由度的平均動能都是kTkT表2.2在0時幾種二氧化碳、CO、NO、HCl二氧化碳屬剛性雙原子分子二氧化碳,發覺常溫下分子平均動能為二氧化碳屬剛性的多原子分子二氧化碳,它們有三個平動、三個轉動自由度,因此單原子二氧化碳單原子N1.491.551.501.471.511.49雙原子二氧化碳2.532.552.492.492.573.02多原子二氧化碳CO3.243.013.164.016.173.42震動能量的能量均分:對于震動能量,除動能外,還有因為原子間相對位置變化形成的震動勢能。
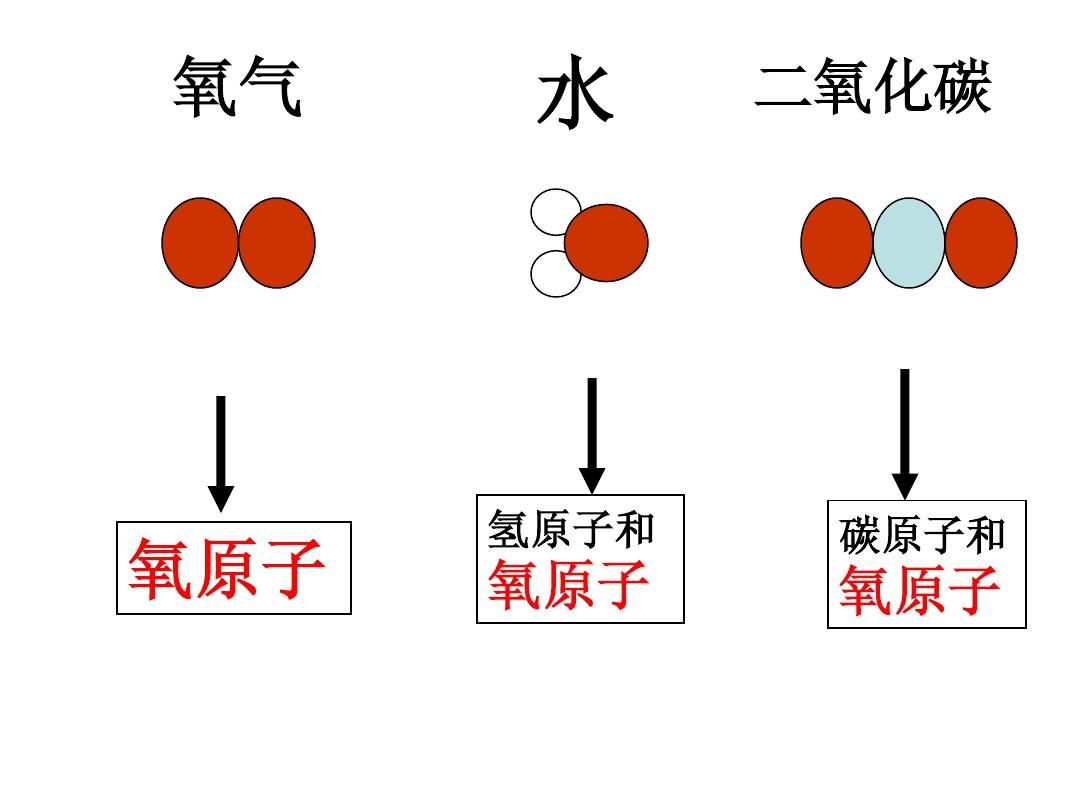
因為分子中的原子所進行的震動都是振幅特別小的微震動,可把它看作簡諧震動。簡諧震動在一個周期內平均動能和平均勢能相等。所以每位震動自由度均分每位震動自由度均分kTkT//22的動能的動能,,還有還有kTkT//22的勢能的勢能。。分子自由度平動轉動每位分子的平均動能幾點說明:(1)能量均分定律只適用于平衡態系統。(2)能量均分定律本質上是關于熱運動的統計規律分子熱運動的實驗,是對大量統計平均所得結果,這可以借助統計數學嚴格證(3)能量均分定律除了適用于理想二氧化碳,通常也可用于液體和固體。(4)對于二氧化碳,能量按自由度均分是借助分子間的大量的無規碰撞來實現的;對于液體和固體,能量均分則是通過分子間很強的互相作用來實現的。三、理想二氧化碳的內能理想二氧化碳的內能:分子動能和分子內原子間的勢能之mol理想二氧化碳的內能理想二氧化碳的內能RT體溫的某過程中吸收的熱量,則物體在該過程中的潛熱C定義為潛熱是:物體下降或減少單位氣溫所吸收或放出的熱量。(一)潛熱(二)理想二氧化碳潛熱與理想二氧化碳內能單原子理想二氧化碳只有熱運動平動動能,沒有勢能。每一分子的熱運動平均平動動能理想二氧化碳的總動能就是內能在等體過程中不作功,所吸收熱量就等于內能降低,即dQdU故摩爾內能為(3/2)RT單原子理想二氧化碳的定體摩爾潛熱表2.2在0時幾種二氧化碳的實驗值單原子二氧化碳單原子N1.491.551.501.471.511.49雙原子二氧化碳2.532.552.492.492.573.02多原子二氧化碳CO3.243.013.164.016.173.42可見,單原子二氧化碳He,Ne,Ar,Kr,Xe差不多為3R/2。
雙原子二氧化碳H差不多為5R/2。多原子二氧化碳CO差不多為6R/2。五、經典理論的缺陷甲烷定體潛熱隨氣溫的變化關系曲線轉動自由度凍結或解凍震動自由度解一切精典理論對此都難以解釋,這需利用量子理論。關鍵是轉動動能與震動動能并不能連續變化,而是分基態的,即能量是量子化的。只能依靠于量子理論,能夠對二氧化碳的潛熱進行比較滿意的解釋。1.振動能對熱阻的影響n,震動量子數,h=6.63x10-34JS(焦耳秒),v震動頻度。hv=10k,二氧化碳氣溫幾十K時,動能也只有幾十K,在碰撞時就不可能是振動能發生變化。開時由量子過渡到精典對熱阻影響小。在幾十動能分子熱運動的實驗,在室溫為幾開時,轉約等于幾十轉矩。為兩原子繞剛體的轉動為轉動量子數,對于多原子二氧化碳,情形是類似的。有時因為分子的震動頻度低,在溫度下震動能多潛熱已有影響。
