蛋白質(zhì)組()的概念最先由Marc提出,指由一個基因組(),或一個細(xì)胞、組織抒發(fā)的所有蛋白質(zhì)()。
蛋白質(zhì)組的概念與基因組的概念有許多差異,它隨著組織、甚至環(huán)境狀態(tài)的不同而改變。在轉(zhuǎn)錄時,一個基因可以多種mRNA方式剪接,一個蛋白質(zhì)組不是一個基因組的直接產(chǎn)物,蛋白質(zhì)組中蛋白質(zhì)的數(shù)量有時可以超過基因組的數(shù)量。蛋白質(zhì)組學(xué)()處于初期“發(fā)育”狀態(tài),這個領(lǐng)域的專家證實它是單純的方式學(xué),如同基因組學(xué)一樣,不是一個封閉的、概念化的穩(wěn)定的知識體系,而是一個領(lǐng)域。
蛋白質(zhì)的研究內(nèi)容
1、結(jié)構(gòu)蛋白質(zhì)組學(xué):主要是蛋白質(zhì)抒發(fā)模型的研究,包括蛋白質(zhì)多肽序列、分析及空間結(jié)構(gòu)的解析種類剖析及數(shù)目確定;
2、功能蛋白質(zhì)組學(xué):主要是蛋白質(zhì)功能模式的研究,包括蛋白質(zhì)功能及蛋白質(zhì)間的互相作用。
蛋白質(zhì)組學(xué)的領(lǐng)域
1、蛋白質(zhì)的微特點以供蛋白質(zhì)的規(guī)模化鑒別和她們的后翻譯飾;
2、“差異顯示”蛋白質(zhì)組學(xué)供蛋白質(zhì)水平與癌癥在廣泛范圍的有力應(yīng)用比較;
3、應(yīng)用特定的剖析技術(shù)如質(zhì)譜法(包括串聯(lián)質(zhì)譜法、生物質(zhì)譜法)或酵母雙雜交系統(tǒng)以及其他蛋白質(zhì)組學(xué)研究新技術(shù)研究蛋白質(zhì)-蛋白質(zhì)互相作用。
蛋白質(zhì)組學(xué)的研究技術(shù)
1、蛋白質(zhì)分離技術(shù)
2、蛋白質(zhì)鑒別技術(shù)
蛋白質(zhì)分離策略
二維凝膠電泳法
二維凝膠電泳的原理是第一向基于蛋白質(zhì)的等電點不同用等電聚焦分離,第二向則按分子量的不同用SDS-PAGE分離,把復(fù)雜蛋白混和物中的蛋白質(zhì)在二維平面上分開。
2-DE有較好的幀率,SDS-PAGE或三相IEF的最好幀率僅為100個蛋白,而2-DE大概為3000個蛋白。
蛋白質(zhì)肽段的鑒別
質(zhì)譜法
質(zhì)譜(mass)是化合物分子在真空條件下受電子流的轟擊或強電場等其他方式的作用,電離成離子細(xì)胞膜蛋白,同時發(fā)生個別物理鍵有規(guī)律的破裂,生成具有不同質(zhì)量的帶電荷的離子,這種離子按質(zhì)荷比m/z(離子的質(zhì)量m與其所帶電荷z的比值)的大小被搜集并記錄程譜的技巧。
生物質(zhì)譜技術(shù)是蛋白質(zhì)組學(xué)研究中最重要的鑒別技術(shù),其基本原理是樣品分子離子化后,依據(jù)不同離子之間的荷質(zhì)比(M/E)的差別來分離并確定分子量。對于經(jīng)過單向電泳分離的目標(biāo)蛋白質(zhì)用胰蛋白酶酶解(酯化Lys或Arg的-C端產(chǎn)生的肽鍵)成肽段,對這種肽段用質(zhì)譜進行鑒別與剖析。目前常用的質(zhì)譜包括兩種:基質(zhì)輔助激光解吸電離-飛行時間質(zhì)譜(MALDI-TOF-MS)和電噴霧質(zhì)譜(ESI-MS)。
蛋白質(zhì)互相作用
1、免疫共沉淀技術(shù)
該技術(shù)以抗原和抗體之間的特異性結(jié)合為基礎(chǔ),除了才能確定生理條件下細(xì)胞或組織內(nèi)2種目標(biāo)蛋白質(zhì)是否存在互相作用,還可以探究與己知互相作用的蛋白。
它的基本原理是在非變性條件下裂解細(xì)胞,保留細(xì)胞內(nèi)互相作用的蛋白質(zhì),將目的蛋白的抗原加入細(xì)胞裂解液中,使目的蛋白在體內(nèi)的互相作用蛋白成電出來。經(jīng)過洗脫,搜集沉淀物并進行分離,最后對分離所獲得蛋白進行鑒別。
該方式所研究的蛋白均是在體內(nèi)經(jīng)過翻譯后修飾的,而且是可分離的天然狀態(tài)的互相作用蛋白復(fù)合物,才能反映正常生理條件下的蛋白質(zhì)間互相作用
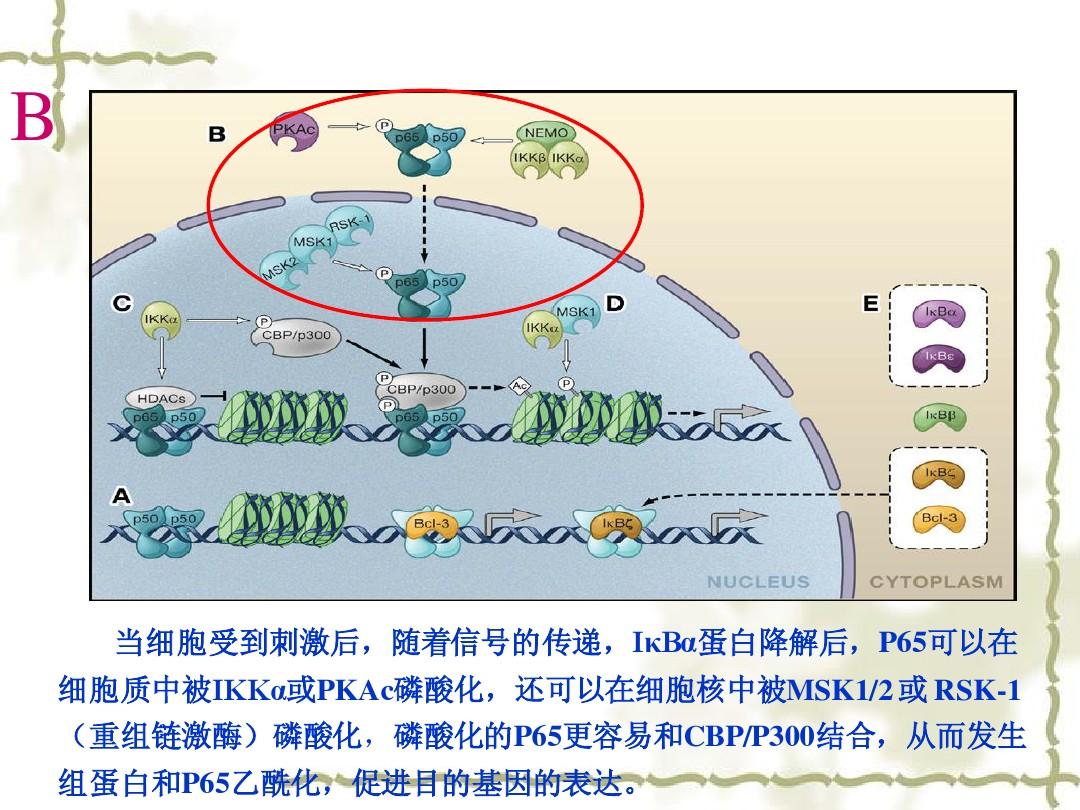
2、酵母雙雜交系統(tǒng)
該系統(tǒng)借助真核細(xì)胞調(diào)控轉(zhuǎn)錄起始過程中,DNA結(jié)合結(jié)構(gòu)域(,BD)辨識DNA上的特異序列并使轉(zhuǎn)錄激活結(jié)構(gòu)域(,AD)啟動所調(diào)節(jié)的基因的轉(zhuǎn)錄這一原理,將己知蛋白X和待研究蛋白Y的基因分別與編碼AD和BD的序列結(jié)合,通過載體引物轉(zhuǎn)到同一酵母細(xì)胞中抒發(fā),生成兩個融合蛋白。若蛋白X和Y可以互相作用,則AD和BD在空間上接近能夠產(chǎn)生完整的有活性的轉(zhuǎn)錄因子,從而啟動轉(zhuǎn)錄,抒發(fā)相應(yīng)的報告基因;反之,假如X和Y之間不存在互相作用,報告基因就不會抒發(fā)。這樣,通過報告基因的抒發(fā)與否,便可確定是否發(fā)生了蛋白質(zhì)的互相作用。
3、蛋白質(zhì)芯片技術(shù)
蛋白質(zhì)芯片是一種新型的生物芯片,才能進列寬通量的蛋白功能剖析。該技術(shù)實現(xiàn)的基礎(chǔ)是蛋白探針在液相支持物(載體)表而的大規(guī)模集成,借助樣品中標(biāo)記或未經(jīng)標(biāo)記的靶蛋白分子與探針進行反應(yīng),之后通過螢光法、放射性核素法或無標(biāo)記測量法等相應(yīng)的方式進行檢查,最后由計算機剖析結(jié)果,獲得高產(chǎn)率抒發(fā)蛋白。
技術(shù)
原理
優(yōu)點
缺點
酵母雙雜交系統(tǒng)
當(dāng)靶蛋白和誘餌蛋白特異結(jié)合后,誘餌蛋白結(jié)合于報導(dǎo)基因的啟動子,啟動報導(dǎo)基因在酵母細(xì)胞內(nèi)的抒發(fā),假若測量到報導(dǎo)基因的抒發(fā)產(chǎn)物,則說明二者之間有互相作用,反之則二者之間沒有互相作用。
蛋白質(zhì)有可能保持天然的折疊狀態(tài),敏感度高,簡捷
假陰性;融合體蛋白必須轉(zhuǎn)運至核內(nèi)能夠活化轉(zhuǎn)錄
噬茵體展示技術(shù)
在編碼噬菌體殼體蛋白基因上聯(lián)接一單克隆抗原的DNA序列,當(dāng)噬菌體生長時,表面就抒發(fā)出相應(yīng)的單抗,再將噬菌體過柱,柱上若含目的蛋白,還會與相應(yīng)抗原特異性結(jié)合
驍龍量,簡便,直接得到基因、高選擇性的篩選復(fù)雜混和物、在篩選過程中通過適當(dāng)改變條件可以直接評價互相結(jié)合
須經(jīng)過真菌轉(zhuǎn)化、噬菌體包裝;文庫短發(fā)子遺傳的多樣性有局限性,有些序列不能抒發(fā),對細(xì)胞有毒性的分子不能抒發(fā)和展示
Pulldown技術(shù)
將靶蛋白-GST/his融合蛋白親和固化在蘆丁親和樹脂上,作為與目的蛋白親和的支撐物,充當(dāng)一種“誘餌蛋白”,目的蛋白堿液過柱,可從中捕獲與之互相作用的“捕獲蛋白”(目的蛋白),洗脫結(jié)合物后通過SDS-PAGE電泳剖析,因而否認(rèn)兩種蛋白間的互相作用或篩選相應(yīng)的目的蛋白
可從體外傳路或翻譯體系中檢測出蛋白互相作用關(guān)系,簡單易行,操作便捷
假陰性
免疫共沉淀
(CoIP)
以抗原和抗體之間的專情性作用為基礎(chǔ)的用于研究蛋白質(zhì)互相作用的精典方式
蛋白處于天然狀態(tài),可以防止人為影響;可以分離得到天然狀態(tài)下互相作用的蛋白復(fù)合體
不能保證沉淀的蛋白復(fù)合物時侯為直接互相作用的兩種蛋白;靈敏度低
Far-
(親和印記)
將PAGE膠上分離好的凡百樣品轉(zhuǎn)移到硫酸纖維膜上,之后檢查哪種蛋白能與標(biāo)記了核素的誘餌蛋白發(fā)生作用,最后定影
可測量不須要自然折疊狀態(tài)的蛋白質(zhì)之間的互相作用
轉(zhuǎn)膜前須要將蛋白復(fù)性
等離子表面共振技術(shù)(,SPR)
借助一種納米級的薄膜吸附上“誘餌蛋白”,當(dāng)待測蛋白與誘餌蛋白結(jié)合后,薄膜的共振性質(zhì)會發(fā)生改變,通過測量便可知這兩種蛋白的結(jié)合情況。
不須要標(biāo)記物和顏料,安全靈敏快速,還可定量剖析
須要專門的等離子表面共振檢查
儀器。
螢光共振能量轉(zhuǎn)移技術(shù)(FRET)
指兩個螢光法色絡(luò)合物在足夠近(
可以在活體中測量,特別靈敏,分辨率高細(xì)胞膜蛋白,才能測量大分子的構(gòu)型變化,才能定性定量的測量互相作用的硬度
此項技術(shù)要求發(fā)色絡(luò)合物的距離大于100埃,設(shè)備高昂,還須要融合GFP給蛋白標(biāo)記。
蛋白質(zhì)芯片陣列技術(shù)
對液相載體進行特殊的物理處理,再將已知的蛋白分子產(chǎn)物固定其上(如酶、抗原、抗體、受體、配體、細(xì)胞因子等),按照這種生物分子的特點,捕獲能與之特異性結(jié)合的待測蛋白(存在于血漿、血漿、淋巴、間質(zhì)液、尿液、滲出液、細(xì)胞溶化液、分泌液等),經(jīng)漂洗、純化,再進行確認(rèn)和生化剖析
可直接用粗生物樣品(血漿、尿、體液)進行剖析,可同時快速發(fā)覺多個生物標(biāo)記物,小量樣品,聯(lián)發(fā)科量,
芯片制備復(fù)雜,蛋白質(zhì)的非特異性結(jié)合,靈敏度和幀率低
蛋白質(zhì)組學(xué)的應(yīng)用
在癌癥及抗生素研究中的應(yīng)用
1、發(fā)現(xiàn)新的疾患標(biāo)志物,鑒別疾患相關(guān)蛋白質(zhì)作為初期臨床確診標(biāo)志。
比如:Lei等通過2-DE和基質(zhì)輔助激光解析電離飛行時間質(zhì)譜等蛋白質(zhì)組學(xué)相關(guān)技術(shù)對膀胱癌病人的尿蛋白進行分離鑒別,獲得14個差別抒發(fā)的蛋白質(zhì),這種差別抒發(fā)的蛋白可能是確診和測量膀胱癌的潛在尿標(biāo)志物。
2、探索癌癥的發(fā)病機制和醫(yī)治途徑
例:等應(yīng)用蛋白質(zhì)組學(xué)方式對遺傳性球狀紅細(xì)胞增多癥的紅細(xì)胞膜蛋白變化進行研究,分離鑒別出56個差別抒發(fā)的蛋白質(zhì),通過蛋白質(zhì)網(wǎng)路剖析出包括細(xì)胞死亡、細(xì)胞循環(huán)及遺傳性和血液性衰弱3個HS相關(guān)的重要網(wǎng)路,為進一步研究和了解HS相關(guān)的發(fā)病機制提供了參考。
3、研究膜蛋白及膜相關(guān)蛋白
Liu等借助比較膜蛋白組學(xué)方式對H5N1病毒分別感染6,12,14h的人肺腫瘤細(xì)胞A549進行蛋白剖析鑒別,得到24個差別抒發(fā)的蛋白質(zhì),其中57%為膜蛋白或膜相關(guān)蛋白,通過siRNA技術(shù)鑒別出與病毒增殖相關(guān)的幾種蛋白質(zhì)。
4、為快速,特異,聯(lián)發(fā)科量的抗生素研究提供了技術(shù)支持
Lin等應(yīng)用蛋白質(zhì)組學(xué)技術(shù)對阿霉素處理的人卵巢癌細(xì)胞的蛋白抒發(fā)變化進行研究發(fā)覺,有37種差別抒發(fā)的蛋白質(zhì),為阿霉素抗性的宮頸癌細(xì)胞的醫(yī)治提供了確診和醫(yī)治標(biāo)志物。
