當地時間2019年2月14日,顏寧研究組在《科學》()背靠背在線發表了題目分別為《μ-芋螺毒素阻斷人源電流門控鈉離子通道Nav1.2的分子機理》(basisforporeofhumanNa+Nav1.2bytheμ-KIIIA)和《人源電流門控鈉離子通道Nav1.7與輔助亞基和植物毒素復合物的結構》(ofhumanNav1.7inwithand)的兩篇研究長文。
兩篇文章分別解析了人源電流門控鈉離子通道(以下簡稱鈉通道)Nav1.2與其特異性阻斷毒素μ-芋螺毒素KIIIA復合物和人源鈉通道Nav1.7與其特異性調節毒素ProTx-II或-IV復合物的冷藏電鏡結構,幀率分別為3.0和3.2埃(1埃=0.1納米),為深入理解鈉通道工作機理、疾病突變致病機理和特異性毒素與其互相作用機理提供了分子基礎,同時為針對鈉通道的氨基酸類抗生素研制提供了可靠模板。
兩篇文章在線發表后鈉離子鉀離子通道阻滯劑,顏寧也第一時間在微博上表示了祝賀:
1:含輔助亞基和植物毒素的人源Nav1.7通道復合體結構
在人電流門控鈉(Nav)通道的九種亞型中,由SCN9A編碼并在外周覺得神經元中高抒發的Nav1.7與腹痛綜合征有直接關系。Nav1.7的突變出現在許多腫脹綜合征中,包括極其腫脹障礙等。Nav1.7的精確結構模型將有助于這一有前途的目標的抗生素發覺。
Nav1.7-PT和Nav1.7-HS的總體結構
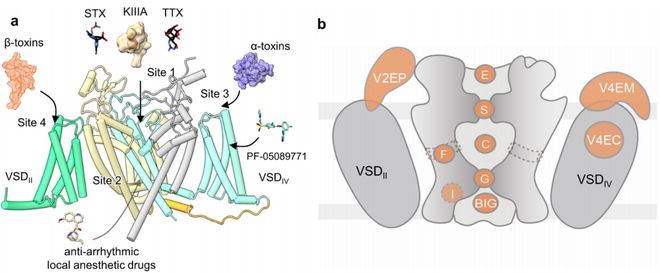
真核細胞人Nav通道具有較高的序列相像性。動物、電鰻和人類具有代表性的NaV通道的冷電鏡結構闡明了核心α亞基的相同結構。一個單一的氨基酸鏈,即α亞基,折疊成4個同源重復序列,每位重復包含6個跨膜螺旋,命名為S1-S6。每位重復序列中的S1-S4片斷構成電流傳感器域(VSD),它附著在由S5和S6螺旋所包圍的中心離子導電孔域(PD)上。VSD和PD段符合在電流門控離子通道(VGIC)超家族中流行的規范域交換組裝。S5和S6之間的序列包括選擇性過濾器(SF),它被兩個半膜穿透的再入孔螺旋P1和P2夾在一起。四個重復序列(Asp/Glu/Lys/Ala(DEKA)中相應的SF位點上的四個不同的殘基是Na選擇(21)的特點基序。
盡管α亞基本身就足以用于離子滲透的電流依賴性門控,但它受一個或多個β輔助亞基的調節。所有四個β亞基,即β1-β4,就會影響Nav1.7的通道特點,雖然β1和β2一般與Nav1.7α亞基共同抒發以進行生物化學表征。電鰻和人類的Nav1.4-β1復合物的結構闡明了α與β1(17,18)之間的互相作用細節,但其他β亞基的結合模式仍有待于結構上的闡釋。
HWTX-IV和ProTx-Ⅱ的結合位點和潛在工作機制
在這兒,研究人員報導了人源Nav1.7-β1-β2復合物與孔阻滯劑和門控改性劑毒素(GMT)結合的冷藏電鏡結構,其中河豚毒素與原毒素-Ⅱ結合,與-IV結合,整體幀率達到3.2?。不僅VSDII的小位移外,這兩種結構幾乎相同,VSDII的S3-S4聯接器以類似的形式容納這兩個GMT。另外一種原毒素-II坐落VSDIV中S3-S4鏈接器的底部。這種結構可能代表一種滅活狀態,所有四個VSD“向上”和細胞內的門關掉。這種結構說明了機械理解Nav1.7的功能和癌癥的途徑,并為結構輔助鎮痛藥的發展奠定了基礎。
原文鏈接:
2:μ-圓柱毒素KIIIA阻斷人源Na通道Nav1.2的分子基礎
電流門控鈉(Nav)通道負責動作電位的快速上升,因而在細胞膜激動性和聯通號傳遞中起著至關重要的作用。NAV通道復合體一般由一個由SCNxA編碼的核心α亞基(x=1-5對應于Nav1.1-NaV1.5,x=8-11,對應于Nav1.6-Nav1.9)和一個或兩個輔助β亞單位組成。當α亞基足夠用于電流傳感器和離子選擇性濁度時,β亞基調節α亞基的膜定位,調節Na電壓的峰值,改變電流依賴性通道激活和失活的動力學。β亞基包括一個羧基(N)末端免疫球蛋白(Ig)結構域、一個單跨膜螺旋(TM)和一個胞內結構域,β1和β3通過非共價互相作用與α結合,而β2和β4分別與α(6-10)產生二硫鍵。
人Nav1.2-β2復合物與μ-圓柱毒素KIIIA結合的冷藏電鏡剖析
來自電鰻和人類Nav1.4與β1的復合物的結構顯示界面在這兩個物種之間是保守的。洞察其他β亞基的辨識主要來自誘變剖析和個體β亞基的結構信息。
不僅β亞基外,NAV通道還遭到各類植物毒液中大量天然毒素的調節。一般有兩類毒素,孔阻滯劑和門控改性劑毒素(GMT)。后者以胍類神經毒素河豚毒素(TTX)和(STX)為例,直接阻斷離子濁度。前者一般是寬度從幾個殘基到幾十個殘基的肽,與電壓敏感域(VSD)結合,改變通道的電流依賴的門控特點。一些肽類毒素,比如從錐形蝸牛中鑒別出的μ-圓柱毒素,也起著孔隙阻滯劑的作用。與小分子孔道阻滯劑相比,肽類阻滯劑具有更嚴格的NaV亞型特異性,因而因為NAV通道的病理生理意義,代表了毒理學意義的線索。
肽類毒素與NaV通道的結合形式不同
動物Nav通道的結構與TTX、STX和GMT,Dc1a互相配合,闡明了那些具有代表性的毒素的辨識和作用形式的分子基礎。在本文中,我們介紹了β1和β2亞基的配合物Nav1.7的結構,以及(1)GMTsPro毒素II()和TTX(Nav1.7-PT)和(II)-IV(HWTX-IV)和STX(Nav1.7-HS)的結構。但是鈉離子鉀離子通道阻滯劑,關于NAV通道與肽類孔阻滯劑之間的分子辨識,還沒有任何結構信息。
在這兒,研究人員報告了在輔助亞基β2存在下,人源Nav1.2與肽類孔阻滯劑μ-cono毒素KIIIA結合的冷藏電鏡結構,幀率達到3.0?。β2的免疫球蛋白(Ig)結構域通過二硫鍵與孔隙結構域的頭部互相作用。16-殘基KIIIA在重復I至Ⅲ中與胞外段互相作用,將Lys7放在選擇性過濾器的入口。許多互相作用的殘基是Nav1.2特有的,闡明了KIIIA特異性的分子基礎。該結構為NaV通道特定亞型阻滯劑的合理設計構建了一個框架.
原文鏈接:
(來源:復旦學院結構生物學高精尖創新中心陌陌公眾號)
