


1803年,英國自然科學家約翰·道爾頓(英國化學家、物理學家)

道爾頓提出了世界上第一個原子理論模型,稱為原子實心球模型,并認為:
(1)化學元素是由不可分割的基本粒子——原子組成的。 他認為原子是所有化學變化中最小的不可分割的單位。 原子是固體、不可分割的實心球,原子是構成物質的基本粒子。
(2)同一元素的原子性質和質量相同,不同元素的原子性質和質量不同。 原子質量是元素的基本特征之一。
(3)當不同元素結合時,原子以簡單的整數比結合。 推導并通過實驗證明倍增定律。 如果一種元素的質量固定,那么各種化合物中另一種元素的質量一定是簡單的整數比。
道爾頓將古老模糊的原子假說發展成為科學的原子理論。 他第一次把原子從哲學帶入科學研究領域,將科學從古代煉金術中解放出來,為現代化學的發展奠定了重要基礎。 基礎。
恩格斯曾稱贊道爾頓為“現代化學之父”。

固體球原子模型

1903 年,約瑟夫·約翰·湯姆森

1897年,湯姆遜發現陰極射線實際上是電子,并第一個提出電子。
1903年和1907年又作了進一步改進,提出了原子的葡萄干面包模型,認為原子是一個球體,是一個均勻分布著正電荷的粒子球,球體內均勻分布著帶正電的物質,一個帶負電的電子。 它們一一鑲嵌在整個球體的同心環中,并在平衡位置產生微小的振動,中和正電荷,從而使整個原子呈中性。
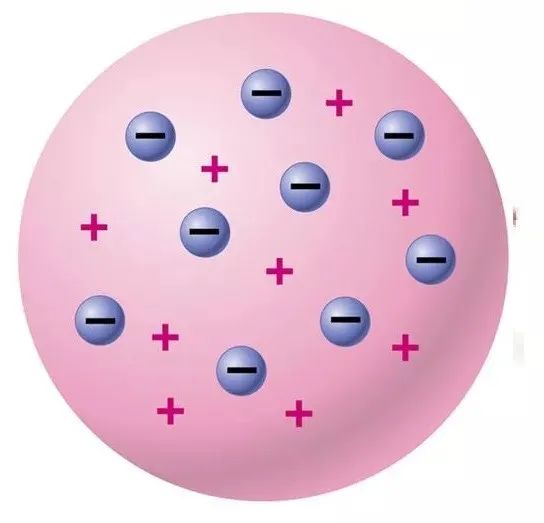

湯姆遜模型,你也可以把這個模型想象成西瓜果肉中長有枝條的西瓜籽,稱為“西瓜模型”(又名話梅布丁模型、棗糕模型、葡萄干包子布丁模型)
葡萄干面包原子模型奠定了現代核理論的基礎。
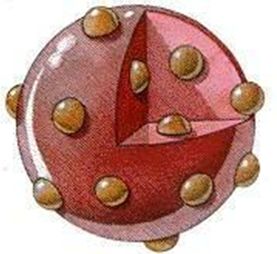
葡萄干面包原子模型


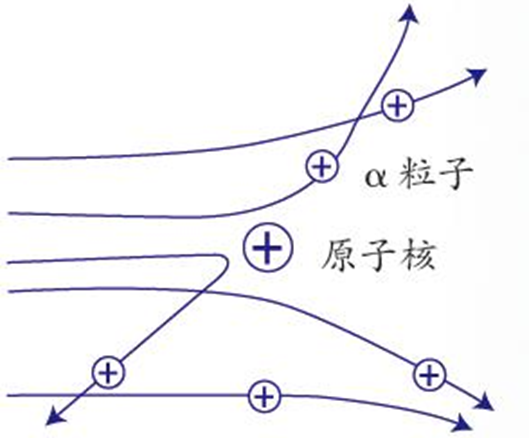
1909年,漢斯·蓋革和恩斯特·馬斯登(Jishi.Y)在盧瑟福的指導下,用α射線轟擊薄金箔,發現絕大多數α粒子(帶正電)都暢通無阻地穿過,并且偏轉角度很小。 大約1/8000的α粒子會以大于90°甚至150°的大角度散射玻爾原子模型,極少數會被反彈回來。
根據葡萄干面包模型,α粒子應該全部反彈回來,而不是穿過“墻”。

α粒子散射實驗

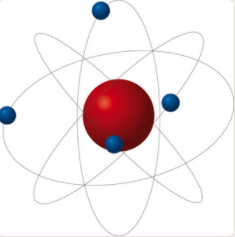
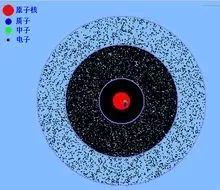
1911年,英國物理學家盧瑟福根據α粒子散射實驗成功證實原子中心存在原子核(該實驗被評為“物理學界最美麗的實驗”之一),并提出了行星模型的原子結構。 電子圍繞原子核運行,就像太陽系中的行星圍繞太陽運行一樣。 原子核位于原子內部。 它體積小玻爾原子模型,但質量很大,并且帶正電,就像繞太陽運行的行星一樣。
由于他的原子模型,他被稱為原子物理學之父。
星系模型很快就遇到了大麻煩。 根據經典電磁理論,繞原子核旋轉的電子會發出電磁輻射并失去能量,瞬間落入原子核中。 行星原子模型明顯與實際情況不符,這讓盧瑟福很頭疼。
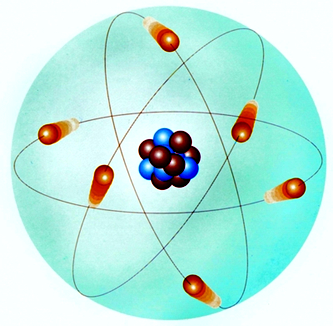
行星原子模型(核結構模型)

1912年,玻爾基于盧瑟福的行星模型引入了普朗克的量子概念。 他提出了原子核外電子的量子化軌道,解決了原子結構的穩定性問題,勾勒出完整、完整、令人信服的原子結構理論。 他假設核外電子的軌道是分離的、不連續的(電子在核外一定軌道上繞核高速運動),即量子化。
量子軌道原子模型將量子假說擴展到原子內部的能量。 假設原子只能通過分離的能量量子來改變其能量,即原子只能處于分離的靜止軌道上,最低的靜止狀態就是原子。 正常狀態。

【量子化軌道原子模型給出了這樣一個原子圖像:電子在一些特定的可能軌道上圍繞原子核做圓周運動,距離原子核越遠,能量越高; 可能的軌道由電子的角動量 h/2π 的整數倍決定; 當電子在這些可能的軌道上運動時,原子既不發射也不吸收能量; 原子只有當電子從一個軌道躍遷到另一個軌道時才會發射或吸收能量,而發射或吸收的輻射是單一頻率,輻射的頻率與能量的關系用公式E=hν表示。 以氫原子為例,假設氫原子核外電子的軌道不是連續的,而是離散的。 在軌道上運行的電子具有一定的角動量(L=mvr,其中m為電子質量,v為電子線速度。r為電子線軌道半徑),只能取如下: =n(h/2π)n=1,2,3,4,5,6...]
玻爾的原子理論首次將量子概念引入原子領域,提出了穩態和躍遷的概念,成功地解釋了氫原子光譜的實驗規則,成功地解決了原子結構的穩定性問題。 玻爾的理論擴大了量子論的影響,加速了量子論的發展。
不幸的是,玻爾的量子軌道原子模型只能有效地描述結構最簡單的氫原子。 但對于稍微復雜的原子如氦原子,玻爾理論無法解釋其光譜現象。 這說明玻爾理論還沒有完全揭示微觀粒子運動的規律。
它的缺點是保留了經典粒子的概念,仍然把電子的運動視為經典力學描述的軌道運動。
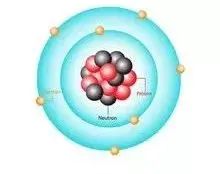
量子軌道原子模型

1926年,奧地利學者薛定諤根據德布羅意關系對電子運動進行了適當的數學處理,提出了二階偏微分薛定諤方程。 這個方程的解的模的平方,用三維坐標圖表示,就是電子云。
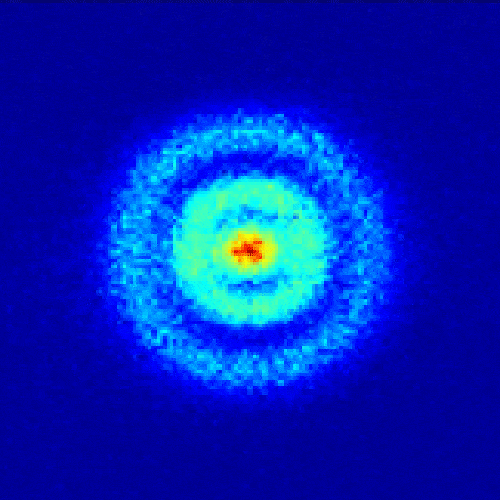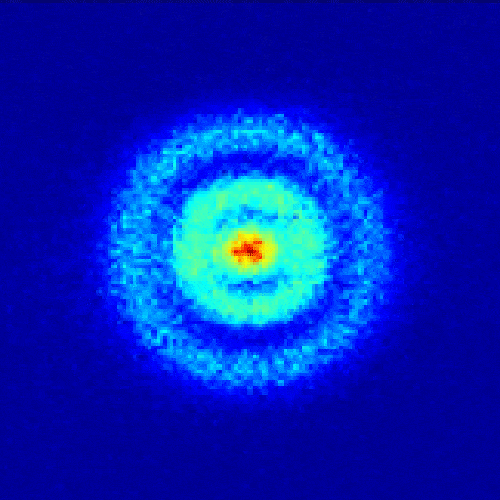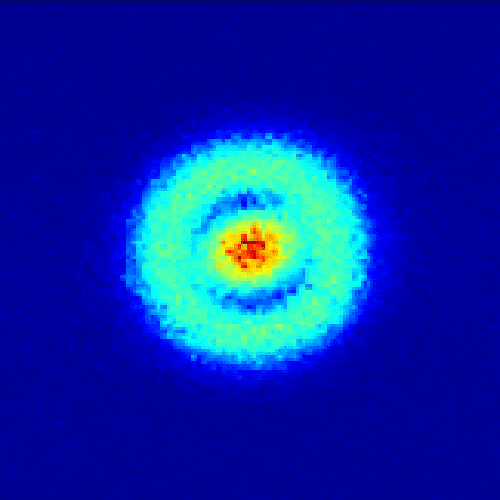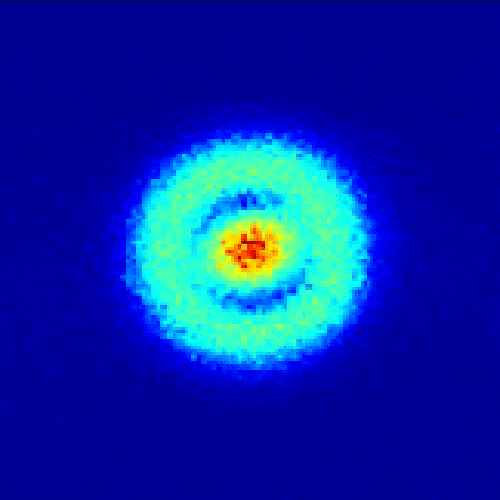
【電子云是電子在原子核外空間分布的統計表示(單位體積空間內電子出現概率的圖形表示)。 電子具有波粒二象性,并不像宏觀物體的運動那樣有確定的軌道。 無法準確預測某個時刻電子會出現在核外空間的哪個位置。 我們只能知道它出現在某個地方的概率。 單位體積內出現電子的概率用小白點的密度來表示。 小白點密集的區域表示電子出現的概率密度高,小白點稀疏的區域表示電子出現的概率密度小。 它看起來像一個樂隊。 帶負電的云圍繞著原子核,因此稱為電子云。 】
電子云原子模型

在微觀量子世界中,人類只能依靠模型來理解亞原子粒子。
在不同的歷史時期,不同的模式可以解決不同的問題。 沒有正確或錯誤的模型。