

2022年3月15日,上海學(xué)院生命科學(xué)大學(xué)李龍研究員課題組在Cell刊物發(fā)表一篇題為“ofainlipid”的研究論文。該論文報(bào)導(dǎo)了磷脂轉(zhuǎn)運(yùn)酶(lipid)在不同脂膜中的氫鍵變化,首次發(fā)覺(jué)該蛋白家族的靜息狀態(tài),為理解細(xì)胞膜非對(duì)稱性的產(chǎn)生提供了重要的分子基礎(chǔ)。
論文截圖
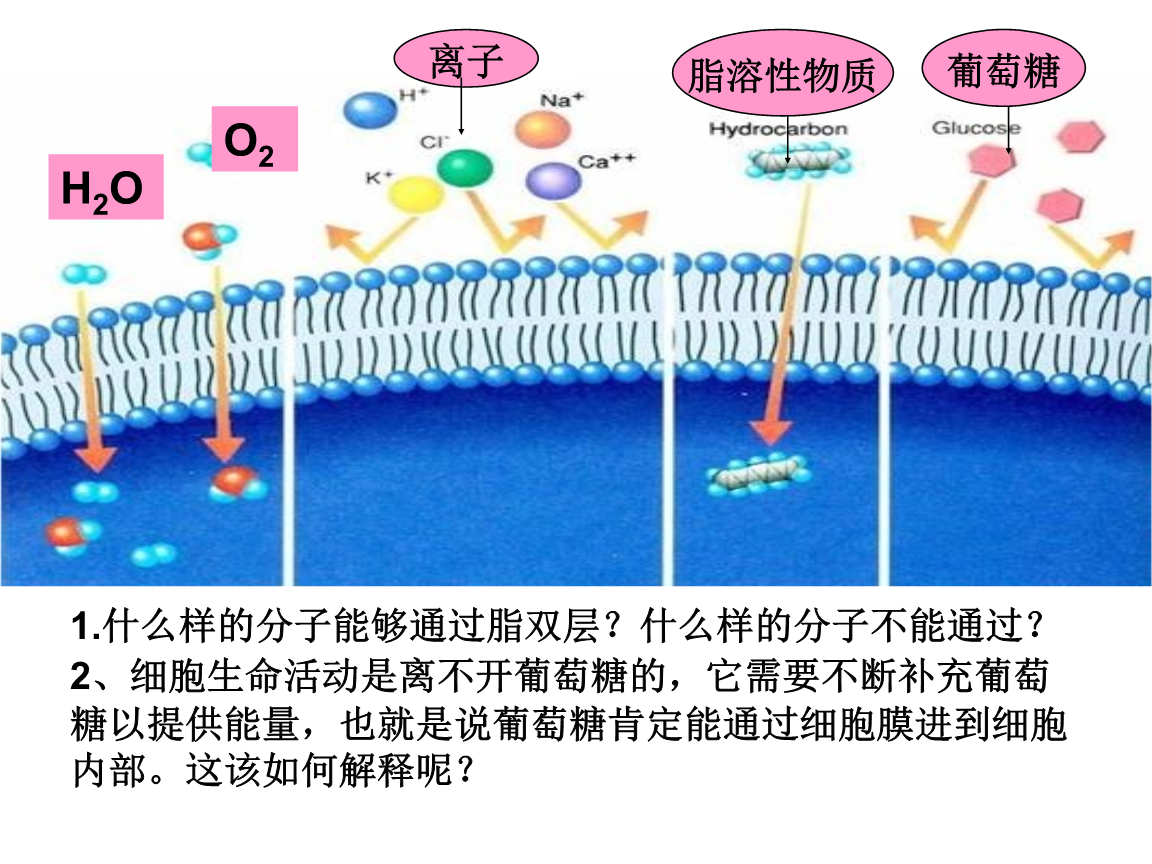
真核細(xì)胞的細(xì)胞膜中細(xì)胞膜穩(wěn)態(tài)劑,雙分子層中的磷脂分子呈非對(duì)稱分布:不同的磷脂分子按照其腹部絡(luò)合物的性質(zhì)不同,被選擇性地富集于細(xì)胞質(zhì)兩側(cè)或則細(xì)胞外右側(cè)。這些非對(duì)稱分布是細(xì)胞諸多生理反應(yīng)的基礎(chǔ)。諸如,使得細(xì)胞膜彎曲,開啟細(xì)胞膜分泌途徑;推動(dòng)血液融化、調(diào)控細(xì)胞自噬,以及介導(dǎo)寄主細(xì)胞和病毒的互相作用等諸多生理過(guò)程。本篇論文的研究對(duì)象磷脂轉(zhuǎn)運(yùn)酶是一類多次跨膜的四型P-type(P4-)。在ATP酯化的驅(qū)動(dòng)下,可以選擇性地將不同的磷脂分子從細(xì)胞膜兩側(cè)轉(zhuǎn)運(yùn)至外側(cè),進(jìn)而調(diào)控和維持細(xì)胞膜的非對(duì)稱性。之前已報(bào)導(dǎo)的P4-家族的蛋白結(jié)構(gòu)都是在去垢劑()環(huán)境中獲得的。考慮到P4-與磷脂雙分子層的緊密聯(lián)系,李龍課題組借助脂納米盤(lipid)技術(shù),將P4-解構(gòu)到磷脂雙分子層環(huán)境中,借助結(jié)構(gòu)生物學(xué)和生物物理等技術(shù)手段探究其工作機(jī)理。
作者以酵母中選擇性轉(zhuǎn)運(yùn)磷脂酰膽堿()的P4-、Dnf1蛋白為代表性研究對(duì)象,將其倒入富含酵母天然脂分子組分的納米盤中,借助冷藏電鏡解析其結(jié)構(gòu),發(fā)覺(jué)了一種在整個(gè)P-家族中都從未報(bào)導(dǎo)過(guò)的蛋白構(gòu)型。在這些氫鍵中,Dnf1跨膜區(qū)中的脂分子轉(zhuǎn)運(yùn)溝被破壞,很可能喪失了轉(zhuǎn)運(yùn)脂分子的能力。物理交聯(lián)實(shí)驗(yàn)顯示該構(gòu)型在細(xì)胞中廣泛存在。細(xì)胞螢光流式剖析否認(rèn),當(dāng)Dnf1被鎖在這個(gè)構(gòu)型時(shí),細(xì)胞轉(zhuǎn)運(yùn)磷脂酰膽堿的效率明顯減少。因而這些新的構(gòu)型很可能代表Dnf1在細(xì)胞中的靜息狀態(tài)。接出來(lái),作者改變納米盤中的磷脂組分細(xì)胞膜穩(wěn)態(tài)劑,借助冷藏電鏡單顆粒剖析發(fā)覺(jué),當(dāng)轉(zhuǎn)運(yùn)底物磷脂酰膽堿在脂膜中的比列增加時(shí),Dnf1自發(fā)地發(fā)生重大構(gòu)型變化,恢復(fù)到活性狀態(tài),跨膜區(qū)的脂分子轉(zhuǎn)運(yùn)溝重新產(chǎn)生。這一系列實(shí)驗(yàn)闡明Dnf1可以感知細(xì)胞膜磷脂雙分子層的組分變化,改變構(gòu)型以滿足磷脂轉(zhuǎn)運(yùn)的須要。細(xì)胞膜的磷脂組分與磷脂轉(zhuǎn)運(yùn)酶的活性存在相互影響調(diào)節(jié)的精致關(guān)系(如圖)。
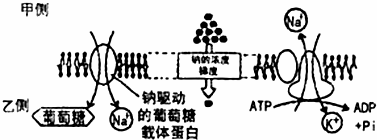
Dnf1-Lem3復(fù)合物工作調(diào)控模型
李龍為該論文的通信作者,博士后許金坤為該論文的第一作者,博士生何以琳全程參與各項(xiàng)實(shí)驗(yàn),為研究做出重要貢獻(xiàn),吳曉飛參與了冷藏電鏡樣品制備和數(shù)據(jù)搜集。生科院冷藏電鏡平臺(tái),非常是王國(guó)鵬博士在數(shù)據(jù)搜集方面提供了幫助,鳳凰工程呂紅霞博士在流式剖析中提供了支持。生科院蛋白平臺(tái)提供了眾多儀器和技術(shù)支持。該項(xiàng)研究得到了清華-北大生命科學(xué)聯(lián)合中心、膜生物學(xué)國(guó)家重點(diǎn)實(shí)驗(yàn)室、國(guó)家自然科學(xué)基金、中國(guó)博士后科學(xué)基金和中心博士后基金的經(jīng)費(fèi)支持。